Crispr技术:蹒跚起步 渐成新宠
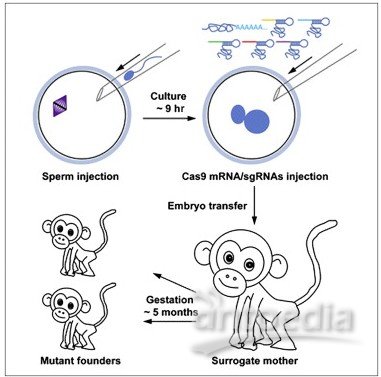
1月30日,《细胞》杂志网站报道,全球首对靶向基因编辑猴子已在中国出生,科学家采用的是最新基因编辑技术Crispr,可以对目标DNA进行插入、删除或重写,类似计算机编辑文字一样让科学家对物种的基因进行编辑,而且成功率一般可提高到30%,甚至50%。美国哈佛大学的George Church说,生物学家最近开发了一些新方法来精确操纵基因,“但Crispr的功效和易用性在各方面都更胜一筹”。
定向改造灵长类意义非凡
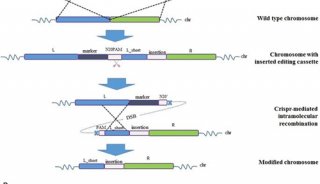
以往尝试对灵长类动物进行遗传修饰都依赖于病毒方法,其虽然能够有效地生成突变,但突变位点不可预知,且突变数量无法控制。中外科学家此前都曾用导入外源基因的方法,创造过转基因猴,但这并非对猴子自身基因的精确编辑。
近年,科学家开发了一些无需病毒的方法,但效率很低,如TALEN技术的成功率大约只有1%。最近,国外科学家已将Crispr技术成功用于体外人类细胞,也有人用其他方法精确敲除猴子成纤维细胞的某一基因,但都停留在细胞层面。
而这次中国科学家的研究证明,不仅可以利用Crispr技术高效、精确地编辑灵长类基因,还能培育出个体。
美国哈佛大学的George Church说,生物学家最近开发了一些新方法来精确操纵基因,“但Crispr的功效和易用性在各方面都更胜一筹”。麻省理工学院合成生物学家张峰(Feng Zhang)是Crispr技术领域的先锋人物,他表示:“这是重要的一步,它证实了这一系统正在起作用。”
将Crispr技术用于猴子是许多实验室渴望的目标,麻省理工学院的McGovern脑研究所主任Robert Desimone说他们也计划将这个技术用于猴。他说中国学者的成功将会增强其他小组使用灵长类开展这一研究的信心。虽然用小鼠可以进行基本的脑生物学和疾病研究,但毕竟不能和猴子比。例如许多药物对小鼠有效,但对人类无效。猴基因编辑的成功将会吸引药物公司的注意,特别是神经科学领域,科学家有望开展猴疾病模型的药物效果评价。
Whitehead生物医学研究所的干细胞研究员Rudolf Jaenisch是20世纪70年代率先构建第一只转基因小鼠之人。Jaenisch认为这一研究结果是一个有趣的证明,但却没有提供多少科学认知。“下一步是看看我们能从中了解到什么东西。”
作者之一黄行许说,Ppar-γ和Rag1组合突变并不代表任何一种特定的疾病综合征,尽管每个基因都与人类疾病相关。该研究小组还没有对猴子的状况进行全面地分析,他们还必须开展进一步的测试评估突变是否存在于这些动物的所有细胞之中。
黄行许说:“我们的第一个目标是着手去完成这项研究,使之起作用。”研究结果表明,研究人员有一天或许能够构建出与多种突变相关的其他人类疾病模型。“我们还有许多事情要做。”
猴子基因组编辑的成功,其最大的意义在于,提示这种技术可用于人类。Crispr技术已经用于体外人类细胞的基因编辑,但没有用在人类胚胎上,更没有培育出个体。科学家相信这一技术可以用于人类,但考虑到安全性因素,距离人体应用仍有很长的路要走。
可一些人似乎等不急了,许多美国Crispr系统的先驱已经成立了公司,希望利用这项技术治疗遗传性疾病。Church的实验室就是首批将该技术应用于人体细胞的实验室之一。美国波兹曼市蒙大拿州立大学生物化学家Blake Wiedenheft说:“我不认为有任何领域的任何例子能够说明这项技术发展得过快。”
Crispr:蹒跚起步,渐成新宠
这种新基因工程工具于1987年被首次报道,一个研究团队在某细菌基因的一端观察到奇怪的重复序列。这一现象当时并未引起太多人的注意。十年后,破译微生物基因组的生物学家经常发现类似令人费解的模式(一个DNA序列紧跟着几乎完全相同但以相反方向构造的序列)。这一模式出现在超过40%的细菌和90%的古生菌中。
很多研究人员假定这些奇怪的序列是毫无意义的,但是2005年,三个生物信息学团队报告,这些所谓的“间隔区DNA”通常和噬菌体的基因序列相匹配,表明Crispr在微生物免疫中可能发挥了作用。加州大学伯克利分校生物化学家Jennifer Doudna说:“这是非常重要的线索。”
马里兰州贝塞斯达市美国国家生物技术信息中心的Eugene Koonin等则提出,细菌和古生菌占据了噬菌体DNA,之后将其作为RNA分子(能阻止外来DNA的匹配)的一个模板保存起来,就像真核细胞利用一个被称作核糖核酸干扰(RNAi)的系统摧毁RNA一样。
2007 年,丹尼斯克公司(一家总部位于丹麦哥本哈根的食品添加剂公司,目前被杜邦公司收购)的科学家Rodolphe Barrangou、Philippe Horvath等找到了一种能增强细菌防御噬菌体能力的方法。他们能通过添加或删除和噬菌体DNA相匹配的间隔区DNA,改变嗜热链球菌对噬菌体攻击的抵抗力,使公司能够为食品生产培育更强壮的菌株。一些基本的原理也被揭示出来:细菌具备一种有高度适应性的免疫系统,使得它们能击退来自某种噬菌体的多次进攻。
在那时,Barrangou(目前就职于美国罗利市北卡罗来纳州立大学)并未充分发挥Crispr的全部潜能。他说:“我们还不清楚这些元素能否像引人注目的基因编辑技术那样,成为随时可利用的技术。”
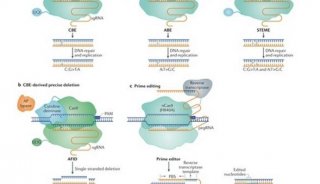
Doudna 与目前任职于德国亥姆霍兹感染研究中心和汉诺威医学院的Emmanuelle Charpentier开展了下一个步骤。他们独立梳理了各种和Crispr相关的蛋白质所发挥的作用,研究间隔区DNA如何在细菌的免疫防御中发挥作用。他们很快转而研究依赖DNA切割酶Cas9的Crispr系统,因为它比其他Crispr系统更简单。
遭遇噬菌体入侵时,Crispr 会作出反应,此时细菌把间隔区DNA和DNA回文序列转录成一串长的RNA分子。tracrRNA(一个额外的RNA片段)和Cas9一起作用产生 crRNA(源自间隔区的RNAs)。Charpentier的团队于2011年将这一发现报告在《自然》杂志上。该团队提出,Cas9、 tracrRNA和crRNA一起以某种方式攻击和crRNA配对的外来DNA。
速度并不是Crispr的唯一优势。Church的团队正在推广TALENs(合成核酸酶)在人体细胞中的使用。在3种类型的人体细胞中,Crispr系统能比TALENs更高效地切割目标DNA,且能比 TALENs处理更多的基因。为了说明Crispr系统的简便性,Church的团队合成了成千上万的向导RNA序列——可锁定90%的人类基因。
张峰等人的论文几乎和Church的同时出现,他们发现Crispr能立刻锁定和切割人体细胞中的两个基因。在和马萨诸塞州怀海德生物医学研究所发育生物学家Rudolf Jaenisch的合作中,Zhang分裂了小鼠胚胎干细胞中的5个基因。
这些工作为培育变异老鼠打下了基础,这是生物医学研究的一个关键工具。一个方法是,将突变鼠的胚胎干细胞植入一个正在生长的胚胎中,这能简单地将Cas9信使RNA和两个向导RNAs注入老鼠的卵子或受精卵中。基于Crispr,科学家构建人类疾病小鼠模型的速度要比之前快得多,能立刻容易地改变细胞中的多个基因,以便研究它们的相互作用。
根据Zhang的Crispr技术,一个新的小鼠模型即将在几周内投入测试。Zhang认为,这种方法并不局限于老鼠。只要你能操纵胚胎并重新植入胚胎,你将可以在更大型的动物(甚至灵长类动物)上开展该研究。
在Zhang和Church的报告在线发表3周之后,Doudna的团队和一个韩国研究小组报告称,他们成功利用Crispr切除了人体细胞的DNA。与此同时,另外一个小组透露,他们利用Crispr创造出变异的斑马鱼。
一系列的研究报告造成了协同效应,为生物界赢得了广泛的关注。去年初,北卡罗来纳州达勒姆市杜克大学生物医学工程师Charles Gersbach说:“如果只是一份报告发表的话,仅会获得一些关注。但是当有几份报告同时发表时,这便意味着它是大势所趋。”
突然之间,不仅是食品科学家和微生物学家,很多领域都意识到Crisp的重要性,在接下来的几个月中,许多科研团队利用它来删除、添加、激活或抑制人体、老鼠、斑马鱼、细菌、果蝇、酵母、线虫和农作物细胞中的目标基因,从而证明了这个技术的广泛适用性。
两年前,当高彩霞看到Doudna和Charpentier的研究报告后,她被他们的理论所折服。高彩霞的团队来自位于北京的中国科学院遗传与发育生物学研究所,已经利用“锌指结构”和TALENs技术在大米和小麦上进行研究。他们通过Crispr,又成功地令大米的4种基因失去功能,这意味着该技术可以用于改良这种重要的农作物。至于小麦,她们剔除了一种基因,使小麦获得了白粉病抗性。Crispr的进展令人兴奋,高彩霞团队的研究报告发表在去年8月刊的《自然—生物技术》上,与此同时,还有另外4篇关于Crispr在植物和老鼠身上的研究成果的报告同期发表。
Crispr的使用成本很低:免费的软件使得设计向导RNA(用于针对特定的基因)的成本为零,另外只需花费65美元便可以从名为Addgene的基因资源库中获取基因,来设计自己的 Crispr系统。自去年开始,Addgene(共有11个科研小组为它提供了可用于Crispr系统的DNA序列)已经见证了5000种Crispr构造的产生。去年7月,Addgene在一周内就收到了(为了设计一种新构造的)100份订单,Addgene的执行董事Joanne Kamens说:“Addgene正在热卖中。”
-
焦点事件

-
项目成果
-
焦点事件
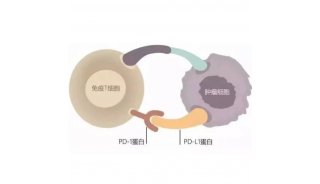
-
项目成果
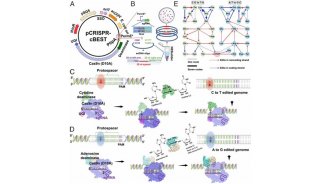
-
并购

-
技术原理
-
项目成果