| 实验步骤 | 一、筛选目的基因片段的参数
1. 序列
( 1 ) 构建一个指定的 RNA 沉默载体首先要进行生物信息学分析。根据目的基因对应的已知 cDNA 序列或预测的基因序列设计引物,用反转录-PCR ( RT- PCR) 方法扩增 cDNA 上的一部分序列。如果没有目的基因的基因组序列,可以用其他物种中基因的序列去搜索已知序列的 cDNA。如果目的基因是多基因家族的成员,就需要与家族成员进行多重比较以指导 PCR 引物的设计。要扩增的基因区域以及它与其他基因的相似性决定了该 RNAi 载体靶向单个 mRNA 还是多个相关基因的转录产物。
( 2 ) 扩增编码区和非编码区(UTR ) 都能获得好的沉默效果。由于沉默机制依靠序列同源性,因此相关的 mRNA 序列有可能被交叉沉默。如果没有特殊要求,应选择与其他序列同源性较低的序列,如 5' 或 3' UTR。为减少交叉沉默,应避免选择与目的基因以外的序列有大于 20 个碱基一致性的区段构建载体。
( 3 ) 目前已经有标准的软件能帮助检测序列同源性,以精确、系统地评估并最大限度地减少 siRNA 序列和目的基因之间 RNAi 脱靶情况的发生[ 45 ] (见注6 ) 。
( 4 ) 除了基因的编码区以外,截短的启动子表达的 dsRNA 也能诱导基因抑制。这种方式诱导转录水平基因沉默(TGS) [46, 47]。
2. 大小
范围在 50~1000 bp 之内的基因片段已经被成功地用作基因沉默的靶标。正确选择片段长度时需要考虑两个因素:片段越短,则沉默的频度越低; 发夹越长,在细菌寄主中发生重组的概率越大。为了达到最优化的沉默效率,我们推荐使用 300~600 bp 片段长度。
二、RNAi
发夹 RNA 载体(hpRNA ) 的产生
构建 hpRNA 的方法有多种。可以利用标准的植物转化载体进行构建,这种方法需要将每个目的基因对应的发夹编码结构都重新构建到载体上。另外,可以使用通用的基因沉默载体,如由 CSIRO ( 澳大利亚)开发的用于谷物转化的 pStarling 和 pStargate 系列载体(http ://www . pi. csiro. au/RNAi/vectors.htm ) 。只需要通过传统的克隆 ( pStarling) 方法或使用 Gateway定向重组系统(pStargate) 将目的基因的 PCR 衍生物克隆到上述载体即可。
1. 克隆与目的 mRNA 同源的 cDNA 片段
( 1 ) RT-PCR 实验中使用的引物需要添加 BamH I 和 Bgl Ⅱ 限制酶酶切位点,用来扩增与目的基因序列一致的、300~600 bp 的片段。BamH I 和 Bgl Ⅱ 作为同尾酶,二者酶切产生的片段末端彼此兼容。该操作保证基因片段能被有方向性地克隆到 PAHC7 载体唯一的 BamH l 位点 [17]。
( 2 ) 内含子片段的克隆策略与上述目的基因的克隆策略相同。
( 3 ) PCR 扩增所采用的程序:94°C 变性 45 s、62°C 退火 45 s、72°C 延伸 90 min,共扩增 35 个循环。
( 4 ) 以 cDNA 片段为模板扩增的产物经如 BamH I 和 Bgl Ⅱ 酶切后被克隆到 PAHC17 质粒的及 BamH I 特异性限制位点(见注 7 和图 12. 3) 。
( 5 ) 反向重复序列组装完成后即可克隆到合适的双元载体上,用于农杆菌介导的植物转化。
2. pSTARLING 载体
( 1 ) 如果将多个目的基因逐一进行沉默将是一件很费力的工作。研究发现 pSTAR-LING 系统转化效率非常高,并且适用于同时沉默少量几个基因。
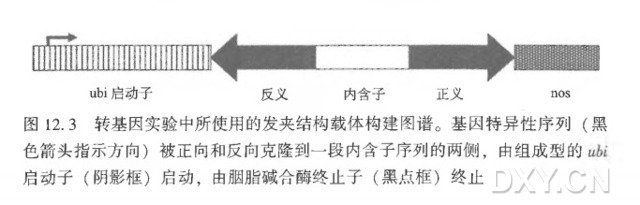
( 2 ) 该载体采用玉米泛素启动子驱动发夹 RNAi 产物在单子叶植物中高水平地组成性表达。
( 3 ) 用传统的限制酶酶切和 DNA 连接技术可将 PCR 片段插入到载体上,反向片段插入到 BamH I Pad I Asc I 多克隆位点,正向片段插入到 SpeI SnaBI KpnI 多克隆位点。
3. pSTARGATE 载体
( 1 ) 该载体可以作为另外一种高通量载体 pSTARLING 的替代产品,采用了商品化可用的 Gateway 克隆系统(http : // www . Invitrogen . com ) , 能沉默大量的基因(如一个基因家族成员或一个通路的成员)。
( 2 ) 该载体也能实现方向性克隆。该体系含有的阴性选择标记(ccdB)能筛选掉无重组反应的载体,并高效地获得重组质粒。
( 3 ) pSTARGATE 载体包含两个重组盒,在反向重复镜像中包含 attP1-ccdB-attP2 或 attR1-ccdB-attR2,因此当基因片段侧翼含有合适的 att 位点时能与载体发成重组产生 ihpRNA 编码的结构。
4. 构建的质粒载体的鉴定
( 1 ) 将扩增的所有 cDNA 片段亚克隆到 pGEM-T 载体。
( 2 ) 连接产物转化 E.coli,并筛选具有氨苄抗性的克隆,用少量细菌培养液提取质粒 DNA,用限制酶酶切图谱鉴定重组质粒。
( 3 ) 为确定克隆的 DNA 片段正确,每一个最终的载体都需要进行 DNA 测序。因为在大工程中存在一个潜在的问题,即大量 cDNA 片段可能被平行克隆并且发生混合。
( 4 ) 每个构建均要进行完整的反向序列片段测序,并将产生的序列和目的基因序列比对之后才能最终确定。
5. 沉默表型的检测
( 1 ) 不同的 hpRNA 转基因株系因为干扰效果的不同会产生一系列程度不同的缺陷表型 [22 , 48 ]。
( 2 ) 由于 RNAi 干扰效果有很大的不同(微弱、中等、强),靶 mRNA 的水平变化可以从与野生型一致到完全检测不到(见注 8) 。
三、VIGS
1. VIGS 接种技术
( 1 ) BSMV 基因组中每一种转录产物(野生型的或经过遗传改造的)以 1 : 1 : 1 比例混合,并加入接种缓冲液 FES [49]。
( 2 ) 将混合物摩擦接种于生长 7 天的植物。戴上手套后,吸取混合物放置于并拢的拇指和食指中间。
( 3 ) 用另一只手握住植物的基部,用戴手套的食指和拇指轻轻挤压第一叶和第二叶。
( 4 ) 并拢的手指轻轻地从基部到尖部滑动两次之后,整个叶片表面均涂满混合物。
2. 用 BSMV 沉默内源的大麦或小麦/基因
( 1 ) 将野生型 BSMV 质粒、βRNA 质粒、不携带植物序列的(BSMV: 00 ) 或含有片段的 γRNA 衍生物质粒的体外转录产物以 1:1:1 比例混合接种于温室生长的大麦和小麦幼苗。
( 2 ) 用 BSMV- PDS 摩擦接种生长 7 天的幼苗的第一叶和第二叶,7 天后,大麦的第三叶和第四叶首次出现明显的白化症状。在小麦中白化现象也发生,但要到病毒接种第 10 天以后才可见( 见注9 和注 10)。
3. 用 BSMV-VIGS 方法鉴定 R 基因介导的抗病通路中所需要的基因
BSMV 侵染后启动 VIGS,而病原菌侵染后启动植物抗性系统。通常二者存在必要的时间间隔且间隔时间一般是8 天。
四、目的基因 mRNA 下调检测
1. 实时定量 PCR
( 1 ) 为了确定 RNA 诱导的外源基因是否影响目的基因的 mRNA 水平,采用两对引物进行定量 RT- PCR 检测。一对引物是特异性地针对目的基因 mRNA 而设计的,用于检测有效的内源 mRNA 水平而非外源基因的转录产物水平。
( 2 ) 第二对引物扩增与靶标 RNA 沉默无关的一个内参基因,如被用作内参的甘油醛-3- 磷酸脱氢酶基因(GAPDH,AF251217)。
( 3 ) 为验证试验可重复性,每个 RNA 样品进行三个重复( 三个 cDNA) 。
( 4 ) 可以用 ABI PRISM 7700 序列检测系统( Applied Biosystems) 及 SYBR GreenPCR 检测混合物 ( Applied Biosystems) 进行实时 PCR 检测。在终体积 26 μl 的反应体系中加入 cDNA 模板以及合适的引物。扩增条件:50°C,2 min;95℃,10 min;95°C,15s、60°C,1 min,40 个循环。
2. 小干扰 RNA 检测
( 1 ) 用看家基因 GAPDH(AF251217,甘油醛-3- 磷酸脱氢酶)作为对照进行杂交。
( 2 ) 转基因植物与野生型植物中杂交信号的相对强度可以用磷屏( phosphoimager) ( Cyclone gene array system, Perkin- Elmer, Boston) 检测。 展开 |
|---|
