山西医科大学Cell子刊发表最新癌症成果
来自山西医科大学、中国医学科学院北京协和医院、深圳华大基因研究所等机构的研究人员,采用全基因组测序(WGS)揭示出了食管鳞状细胞癌多样的结构变异模式。研究论文发表在Cell出版社旗下的子刊《AJHG》杂志上。
山西医科大学的崔永萍(Yongping Cui)教授和中国医学科学院副院长詹启敏(Qimin Zhan)院士是这篇论文的共同通讯作者。崔永萍教授主要从事恶性肿瘤的病因学、细胞生物学、遗传学及基因组学领域的研究工作。詹启敏院士多年来主要从事肿瘤分子生物学研究,曾在国际上率先发现和系统揭示细胞周期监测点关键蛋白的作用和机制,报道抑癌基因p53的最重要生物学功能,并发现第一个p53调控靶基因。
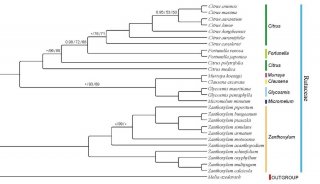
食管癌(EC)是人类常见的消化道恶性肿瘤之一,发病率及死亡率分别居世界第8位和第6 位。食管癌主要有2种不同的临床病理类型:食管鳞癌(ESCC)和食管腺癌(EAC)。全球大约70%的ESCC发生在中国,而太行山区是世界著名的食管鳞癌高发地之一。食管癌的发生除了与吸烟、饮酒、微量元素缺乏、喜烫食等环境高危因素有关外,遗传变异因素在食管癌的发生发展中起着尤为关键的作用。
2015年,崔永萍教授和詹启敏院士合作,采用全基因组测序及全外显子测序的方法,揭示出了ESCC的一些突变标签和频繁突变的基因。为我们提供了关于ESCC突变标签的全面认识,并鉴别出了一些早期诊断标记物和潜在治疗靶点。
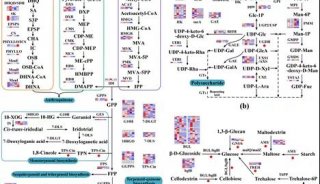
在这篇新文章中作者们指出,综合分析体细胞结构变异(SVs)及了解癌症中的突变机制有可能帮助认识生物学差异及鉴别出一些新的治疗靶点。不幸地是,目前很大程度上仍不清楚整个基因组复杂SVs的特征及ESCC的潜在突变机制。
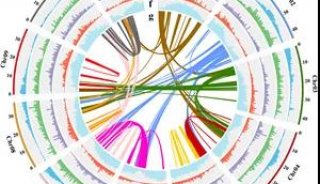
为了确定ESCC中体细胞SVs、受累靶基因的综合目录及它们潜在的机制,研究人员采用Meerkat算法重新分析了来自31个ESCCs的全基因组测序数据,预测了体细胞SVs和拼接确定了拷贝数改变。他们发现NHEJ和alt-EJ造成的缺失与易位是主要的SV类型,16%的缺失是复杂缺失。 SVs往往会破坏具有不同突变机制的癌症相关基因(如CDKN2A和NOTCH1)。
此外,研究人员确定染色体碎裂(chromothripsis)、kataegis突变和断裂—融合—桥接(BFB)造成了染色体局部排列错误,这种情况发生于55%的ESCCs中。这些基因组灾难通过染色体碎裂引起的双微染色体形成(如FGFR1和LETM2)或受到BFB影响的染色体(如 CCND1, EGFR, ERBB2, MMPs和MYC)造成了癌基因扩增,大约30%的ESCCs包含BFB引起的CCND1扩增。
通过分析拷贝数变异,研究人员揭示出了高频的全基因倍增(WGD)和CDCA7频发焦点扩增,CDCA7有可能是ESCC中一个潜在的癌基因。研究结果揭示出了在ESCCs恶变中染色体碎裂和BFB一类的分子缺陷,证实在ESCC中存在多种模式的SVs衍生靶基因。这些全基因组SV图谱及它们的潜在机制对于预防、诊断和治疗ESCCs具有重要的意义。
近年詹启敏院士在ESCCs研究中取得不少突破性成果。2014年,詹启敏院士领导中国医学科学院、深圳华大基因研究院等机构的研究人员,采用全基因组测序、全外显子组测序和比较基因组杂交芯片分析等方法,对来自广东省潮汕地区的158名食管鳞状细胞癌(ESCC)患者展开研究,鉴别出了这类癌症的一些基因组改变。这一重要的研究成果发表在Nature杂志上。2015年,在Oncogene杂志上发表文章,揭示了血小板活化因子受体(PAFR)在ESCC恶性演进中发挥的作用。
-
企业风采

-
政策法规

-
标准

-
企业风采

-
企业风采

-
精英视角

-
企业风采

-
焦点事件

-
科技前沿

-
项目成果
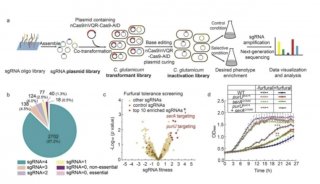
-
科技前沿

-
企业风采

-
企业风采

-
焦点事件

-
科技前沿

-
企业风采

-
项目成果
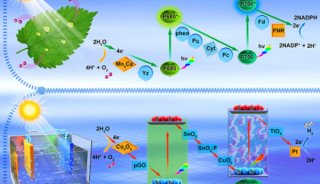
-
企业风采

-
科技前沿

-
科技前沿
-
投融资

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿
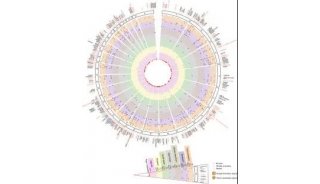
-
项目成果
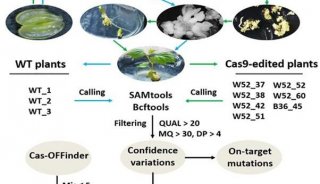
-
焦点事件

-
焦点事件

-
项目成果

-
企业风采

-
精英视角

-
项目成果
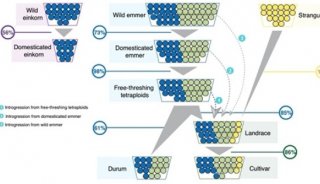
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
综述

-
会议会展

-
焦点事件

-
项目成果
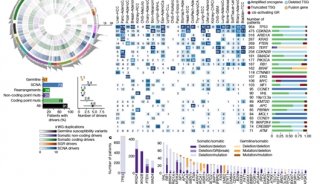
-
企业风采
-
项目成果

-
焦点事件

-
项目成果
-
焦点事件

-
科技前沿
-
科技前沿