重磅:神奇的手性分子筛终于来了,制药界或迎来巨变
上个世纪六十年代,出现了一个怪现象,在短短的几年时间内,全球范围内有1万多新生婴儿患上了一种叫做海豹肢症(形似海豹)的疾病。要知道,海豹肢症是一种极其罕见的疾病,怎么会突然大面积爆发?
科学家迅速展开大范围的调查研究,最终发现罪魁祸首是一个叫做沙利度胺(又名反应停)的药物。反应停是上个世纪五十年代推出的一种镇静剂,由于对孕妇早期的恶心、呕吐等妊娠反应非常有效,深受广大妇女的喜爱。
然而,让反应停的制造商Grünenthal GmbH没想到的是,他们生产的反应停是一种药物,也不是一种药物。当然,我们今天不是在讨论哲学问题。那这句话是啥意思呢?
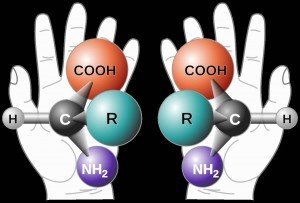
我们先来看个例子。大部分人都有两只手,虽然都叫手,但是一般人都能明显感觉到左手和右手是不同的。我们可以说它们长得一模一样,但是却又完全不一样。因为他们是镜面对称的,是不能重合的。对于左撇子而言,左手好使,正常人是右手好使。生活中有些事是左手干,有些事是右手干,反过来就别扭,甚至把事情搞砸。科学家把这种现象叫做「手性」。
说到这里,你也许已经意识到了,那个反应停肯定也是存在「手性」现象。确实,后来科学家发现,反应停这种药在生产的过程中会出现两种呈「手性」对称的构象。它们不叫左反应停和右反应停,而是叫R-反应停和S-反应停。R型有显著的抑制妊娠反应的药理作用,而S型则会产生严重的至畸形副作用(4)。
这一事件引起了人们对具有「手性」性质的药物极大的关注,FDA也对这类药物的临床研究做了明确的规定。在制药领域,56%的药物都具有「手性」特点。这咋办呢?除非你能证明混在一起没有副作用,否则你就得从混合药物里尽可能踢掉另一种。这就好比,从不计其数的猪蹄儿中挑出左蹄儿卖。猪蹄儿好歹有那么大,在「富士康」级别的流水线上很快就能分拣完了,但是化学药物分子那么小,那么多,咋办。
实际上对于手性化合物的分离,一直是化学领域的热门课题。虽然目前有多种手性化合物分离的方法,但都费时费力,成本昂贵,极大的限制了手性化合物的应用。
时间来到2017年。今年4月,在加利福利亚理工大学,由 Mark E. Davis教授带领的一组国际研究人员成功的研发出世界上第一个手性分子筛(1)。这一发现无疑在化学和生物学领域开辟了新的研究领域,并将广泛运用于制药公司和其他的化工企业。这一发现将极大的提高手性化合物的市场占有率。
Davis教授发明的这个筛子到底有多厉害,我们暂且不表。先说说为什么同样的化学组成却能形成空间不同的两种结构?
当碳原子在形成有机分子时有时会与四个基团相连接,碳原子连接四个基团形成空间三维结构。当这四个基团都不同时它会形成两种分子结构,这两种分子关于镜面对称,却不能重合。也就是说这两种分子结构代表了两种不同的物质。由于这两种物质在三维空间内无论怎么做都不能让它们重合,就像人的左右手一样,因此人们将这两种物质称为「手性」分子,这两种物质在物理性质上几乎相同,但是在化学性质上却相去甚远(2)。
手性分子
其实「手性」离我们并不远。对于「手性」化合物的有记载的研究最早可以追溯到1848年。在1848年之前,人们并不知道光学异构体以及外消旋体(两种异构「手性」分子的等量混合物)的存在,更不知道如何将外消旋体中的两种光学异构体分开。然而1848年法国化学家,生物学家路易斯巴斯德在酿酒的过程中发现了一种叫酒石酸铵钠的化合物,并且在28摄氏度下结晶过程中产生了晶型完全不同的两种结晶,之后他便来测量这两种晶型的旋光度,结果一种结晶产生向右的偏振光,一种结晶产生向左的偏振光,而将这两种晶体等量混合后失去旋光活性。因此巴斯德是发现「手性」的第一人(3)。
然而,人们花了近一个世纪才发现「手性」在动植物,农业,化工以及药学中起到了非常重要的作用。所有的蛋白质,酶,核酸一部分的生物碱和激素都是「手性」化合物。与人工合成的手性产物相比,所有天然的「手性」物质都是单一的光学异构体,比如,所有自然界的氨基酸都是有左旋光性的,而所有天然的糖都是具有右旋光性的,这与动植物体内的所有酶,受体等都具有高度的立体选择性相关(4)。
尽管这些异构体具有相同的化学组成,但是大部分外消旋体药物中的两种光学异构体在药理作用,毒性,代谢上有显著的差异。单一异构体药物的使用,往往比外消旋的混合物的使用效果更好,毒性更低,患者依从性也更好。例如,常用的心血管药物β肾上腺素受体阻断剂普萘洛尔,左旋异构体比右旋异构体的活性高出了100倍,常用的治疗帕金森病的药左旋多巴,其右旋异构体会造成不可耐受的副作用(5)。
因此,对外消旋体药物的拆分的或者直接合成单一的对映异构体对于制药工业,化工业等就显得格外重要。目前用于手性药物拆分的最主要的方式就是高效液相色谱法(HPLC)。而单一对映异构体的合成主要通过不对称合成来实现。2001年的诺贝尔化学奖就授予了三位致力于手性催化氢化的科学家,威廉·诺尔斯,他发现可以使用过渡金属来对手性分子进行氢化反应,以获得具有所需镜像形态的最终产品。野依良治进一步完善了用于氢化反应的手性催化剂的工艺。而巴里·夏普莱斯开发出了用于氧化反应的手性催化剂。
三位诺贝尔化学奖获得者
「手性」分子筛的发现将有望极大降低单一对映异构体药物的生产成本,使其在药品市场中占据主导地位。通过计算机辅助设计,研究人员通过使用有机结构导向剂与无机组分进行反应,产生结晶的有机无机复合材料。之后去除有机结构导向剂,产生各种应用(催化,分离,离子交换和吸附等)所需的,与有机结构导向剂空间结构相关的直径小于2nm的耐高温,耐水解的微孔(6)。
这些小孔是「手性」分子筛发挥作用的关键部位。其实分子筛就相当于一个过滤器。在分子筛内部的数百万个小孔内,只有与有机结构导向剂大小,结构相似的化合物才能进入小孔内,被保留,而其他化合物被洗脱掉,从而达到分离的效果。因此通过改变有机结构导向剂的结构以及在无机材料上添加不同的催化剂,可以生产各种不同的分子筛,提供形状选择性能,并且与包含催化活性位点相结合,能够产生无数高选择性的化学反应。从而人们可以低成本生产所需要的左旋对映异构体,右旋对映异构体或者消旋体(6)。
总而言之,「手性」分子筛不仅可以用于单一对映异构体的合成,也能用与外消旋体的拆分,而且还能重复使用,能最大限度的降低制药产业,化工产业等的成本。未来药品市场一定属于单一对映异构体药物。
-
科技前沿
-
焦点事件