ANSI/AAMI ST72:2019法规概述及其与Sievers Eclipse月食细菌内毒素检测仪的关系

背景
美国医疗器械促进协会(AAMI,Association for the Advancement of Medical Instrumentation)是医疗器械行业的国内和国际通用标准的主要制定者,也是医疗技术和消毒领域专业人员获得实用信息、支持和指导的主要机构。AAMI标准化计划获得美国国家标准化协会(ANSI,American National Standards Institute)关于医疗保健技术产品、工艺和相关服务的认证。
具体而言,ANSI/AAMI ST72:2019细菌内毒素规则标准为细菌内毒素检测(BET,Bacterial Endotoxins Test)提供了指导,并规定了使用鲎试剂细菌内毒素检测法来检测医疗器械、部件、原材料上的细菌内毒素含量的通用标准1。
正如USP第<85>章2,ANSI/AAMI ST72:2019还讨论了细菌内毒素检测法的药典要求,以及细菌内毒素检测法在适用要求下的有效性。这包括但不限于以下内容:
鲎试剂和分析员的资格确认
线性
标准曲线范围
阳性产品对照(PPC,Positive Product Controls)
阳性产品对照回收范围
ANSI/AAMI ST72要求
光度学检测技术(包括动态浊度法和动态显色法)需要使用整个内毒素浓度检测范围的线性标准曲线。线性要求相关系数的绝对值|r|在鲎试剂(LAL,Limulus Amebocyte Lysate)生产厂家所规定的内毒素浓度范围内必须大于等于0.980。这适用于每一次检测,包括对鲎试剂和分析员的资格确认。
鲎试剂资格确认:
必须使用至少3个内毒素浓度来生成标准曲线。对于每个内毒素浓度,必须测试3次并生成大于等于0.980的相关系数值|r|。
分析员资格确认:
与鲎试剂资格确认相似,分析员必须运行至少3个内毒素浓度的标准曲线。对于每个内毒素浓度,必须测试3次并生成合格的|r|。
阳性产品对照(PPC):
阳性产品对照必须至少一式两份,并且在位于或接近标准曲线的中间浓度处有一个内毒素加标值。阳性产品对照的实测内毒素接受标准为50 - 200%之间。
样品:
样品必须至少一式两份。
标准曲线:
至少有3个浓度,每个浓度至少有2个重复值。
阴性对照:
必须至少一式两份。
Sievers® Eclipse
月食细菌内毒素检测仪的合规性
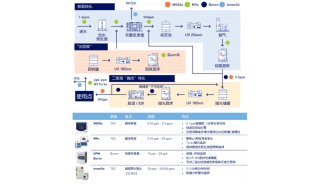
Sievers® Eclipse是完全合规的内毒素检测仪,满足美国药典USP <85>、欧洲药典EP 2.6.14、日本药典JP 4.01、中国药典ChP、ANSI/AAMI ST72所规定的药典要求,这些要求满足总体接受标准。
Eclipse自带标准曲线,提供5个浓度(范围为50-0.005 EU/毫升,一式三份),每个样品均带阳性产品对照,因此确保满足检测的所有规则要求。

参考文献
ANSI/AAMI ST72: Bacterial endotoxins - Test Methods, routine, monitoring, and alternatives to batch testing.
USP <85> Bacterial Endotoxins Test.
◆ ◆ ◆
联系我们,了解更多!
400 887 8280
sievers.china@veolia.com
cn.sieversinstruments.com