工程细胞株开发系列之细胞转染

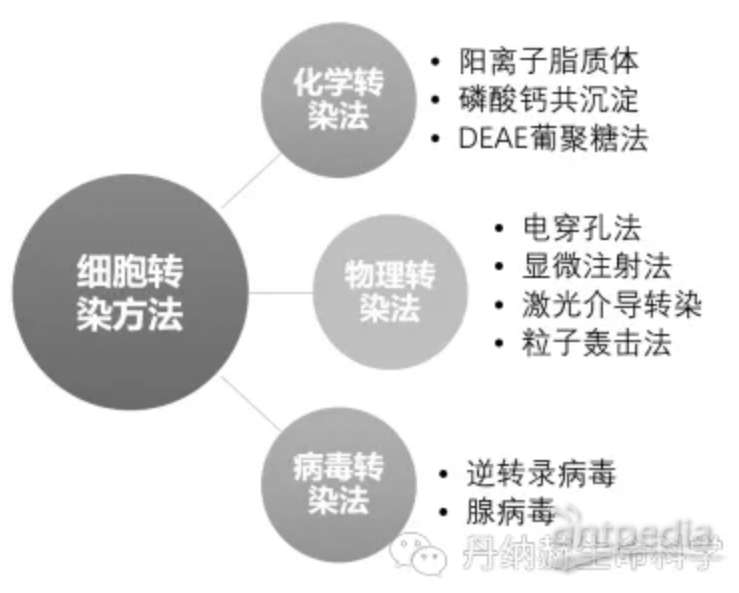
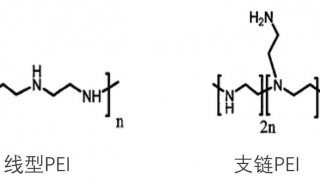
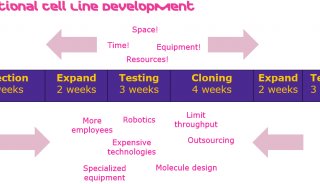
在工程细胞株开发中,选择好合适的表达体系后,下一步需要让核酸进入细胞并表达目的蛋白。前一篇文章中提到的三种表达体系(微生物、哺乳动物细胞和昆虫细胞),因为转染的方法不同,优化思路与策略也有区别。本文以哺乳动物细胞为例,详细讨论转染方法对比,以及如何优化。下图归纳了常见转染技术。
Part 1
常用转染方法对比
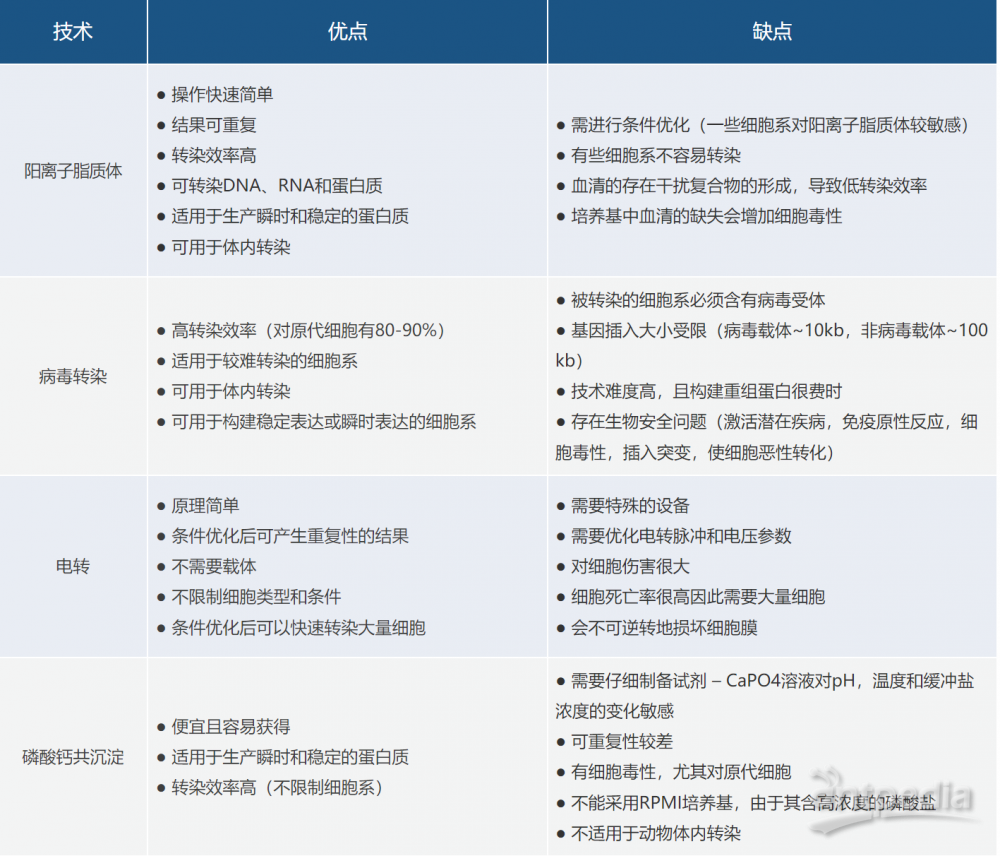
没有一种方法适用于所有的细胞和实验,需要根据细胞类型和实验进行选择。理想的方法应具有高转染效率,低细胞毒性和对正常生理学的影响最小,并且易于使用和具有可重复性等特点。常用于哺乳动物细胞转染的方法有磷酸钙法、阳离子脂质体法、病毒转染法和电穿孔法。
Part 2
转染优化推荐
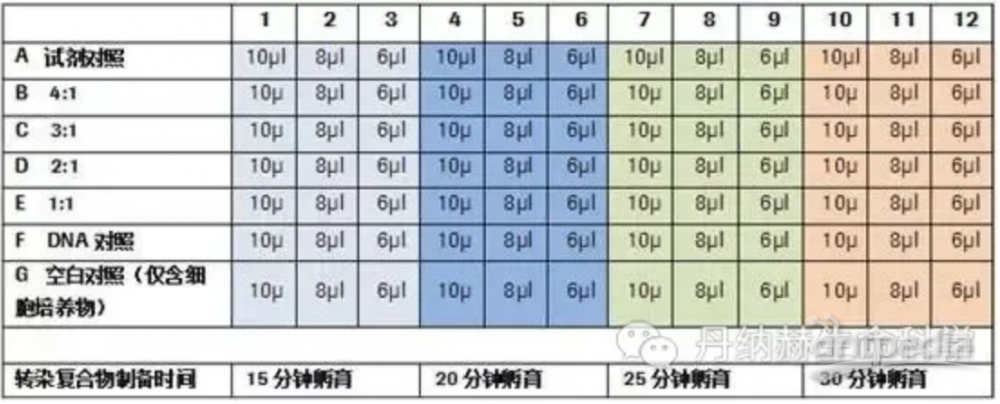
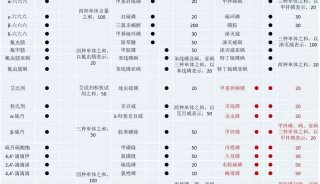
在正式开展转染实验前要多做预试验,优化转染条件。以脂质体转染优化为例,优化转染条件包括:脂质体的用量、DNA密度、细胞密度、脂质体和DNA混合孵育时间等等。首先,由于不同质粒和脂质体的最佳搭配比例不同,转染前应该做预实验来摸索一个最佳配比。作预实验时,按照质粒:脂质体=1:1、1:2、1:3、1:4的梯度来检测最佳转染比例,如下表所示:
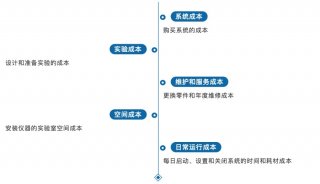
摸索最佳转染条件需要耗费大量的时间,且手工操作很容易引起误差,在这一步可以考虑使用自动化工作站来替代人工操作。节约时间的同时还可以保证极高的实验稳定性,减少了需要重复实验验证的人力与物力。如何使用自动化工作站优化转染条件,可以参考此文章:高效的转染条件优化:多因子平行

Beckman Coulter Biomek i-Series
Automation Workstation
转染时的细胞密度对转染效率影响非常显著。不同的转染试剂,要求转染时的最适细胞密度各不相同,即使同一种试剂,也会因不同的细胞类型或应用而异。转染时过高或者过低的细胞密度会导致转染效率降低,乃至表达水平偏低。因此如果选用新的细胞系或者新的转染试剂,最好能够进行优化实验并为以后的实验建立一个稳定方法,包括适当的接种量和培养时间等等。一般转染时贴壁细胞密度为40%-80%。
整个工程细胞株开发过程中,在做细胞培养、转染、筛选时,我们需要时刻关注细胞的活率和状态,但这样的工作人工操作时需要考验检测人员的眼力、耐心和专注力,而且可能会存在一定的人工误差。丹纳赫生命科学旗下贝克曼库尔特生命科学的Vi-CELL BLU 细胞计数和活力分析系统可以全自动进行细胞活力分析与细胞计数,无需人员之手,帮助用户实现标准化的细胞计数和活力分析,是生物制药行业计数和活力测试的标准分析方法之一,其软件满足21 CFR part 11,符合审计追踪的要求。

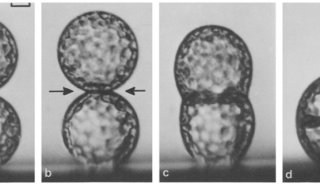
另一种在工业界应用较多的转染方法是电穿孔法。做电转的时候,如果电压太大,往往会发生细胞大量死亡的情况。不同的细胞,需要的电压是不一样的。对于大多数细胞来说,其最佳电压位于250-1250v/cm。进行转染的细胞应该处于对数生长期。处于对数生长期的细胞的抗损伤能力是最强的。细胞浓度应该处于5x106到1x107/mL之间。每次转染的质粒应该控制在4-6 μg,如果﹥10μg,转染效率也大大降低。
转染成功后需要建立稳转株,上一篇文章中(工程细胞株开发系列之表达系统对比)简单介绍了两种筛选方法:抗生素型与代谢型筛选标记。筛选后的细胞会形成mini pool,但这其中的细胞是异质化的。下一篇文章我们会讲如何从mini pool形成单克隆,并且形成满足申报要求的单克隆源性证明材料。
声明:此文版权为丹纳赫生命科学所有,如需转载请联系。
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
(1).jpg!a320x184.jpg)
-
厂商文章
.png!a320x184.jpg)
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
.png!a320x184.jpg)
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章








