手性配体交换色谱法的建立及分离条件优化策略
随着手性药物研究的广泛开展,各种手性分离技术应运而生。由于手性药物对映体生物活性存有显著差异,因此药品管理部门明确要求在有关新药申请报批过程中,必须对光学异构体开展化学(对映体纯度鉴别、检查、含量测定、稳定性考察等)、药理学(单一构型对映体和消旋体的药效学、体内体外药动学、生物利用度等)、毒理学(药物-药物相互作用)以及临床应用等研究。欲开展这些工作,必须首先解决手性化合物拆分问题。因此,建立手性分离分析方法成为开展手性药物研究过程中的关键一环。
在药物合成反应中,采用适当的手性源来合成光学活性物质是一种重要的方法。氨基酸、氨基醇、羟基酸等作为一种常见易得的手性源在合成含氮、含氧手性化合物的过程中有着广泛的应用。但由于氨基酸、羟基酸等诸如此类的化合物结构简单、水溶性强(极性大)、无明显发色基团等,手性分析中广泛使用的多糖衍生物固定相正相分离模式难以适用。根据这类化合物的结构特点,本文简单介绍手性配体交换色谱法的建立及分离条件优化策略。
关键词:手性配体交换色谱法(Chiral ligand-exchange chromatography,CLEC) 氨基酸(Amino Acids) 羟基酸(Hydroxy Acids) 氨基醇(Amino Alcohol ) 二肽(dipeptides)
1. 背景知识介绍——何谓配体交换色谱法?
配体交换色谱(Ligand Exchange Chromatography,LEC),顾名思义,这一技术具有“配位”&“交换”两大特征,即中心金属离子(如Cu2+、Ni2+、Co2+等)结合在硅胶(或者聚合物)载体上,待分离物通过与金属离子的配位(络合)作用或与金属离子络合的配体发生交换而实现分离。
2. 手性配体交换色谱法
手性配体交换色谱法(Chiral ligand-exchange chromatography,CLEC),根据手性配体(手性选择子)所处环境(流动相或固定相),可分为配体交换手性流动相添加剂法和配体交换手性固定相法两大类。从手性识别机理来讲,氨基酸、羟基酸等待分离物与手性固定相 (CSP)或手性流动相添加剂(CMPA)、中心金属离子三者形成配位络合物(非对映体复合物),由于非对映体络合物相对稳定性不同而致使表现对映体分离的选择性。
3. 手性配体交换色谱固定相(配体交换型手性柱)
商品化的配体交换型手性柱,通常是以青霉胺或光学纯的氨基酸及其衍生物等为手性选择子(手性配体),通过化学键合方式或直接涂敷在ODS硅胶表面(或者聚合物载体上)。在反相模式中通过配位交换相互作用进行手性识别而拆分手性化合物,尤其适用于未衍生化的氨基酸、羟基酸、氨基醇、二肽、二醇、二胺、糖类、核苷、核苷酸及衍生物等有双配位基的化合物。较常用的商品化配体交换型手性柱有Phenomenex公司的Chirex系列手性柱(比如Chirex 3126)、Sumichiral OA系列手性柱(比如OA-5000)、Astec CLC-D/L 手性柱、Macherey-Nael手性柱(比如Nucleosil Chiral-1)等。
4. Chiral ligand-exchange chromatography方法建立
手性柱
假定手头上已有商品化的配体交换型手性柱,面对某一具体待分离物,该如何着手开展Chiral HPLC方法建立呢?
总体原则——手性HPLC与普通C18柱液相色谱分析基本一致——“出得来,分得开,尽量快”。
具体步骤:
第一步:“看”
查看待测物的化学结构(官能团),观察取代基类型及所处位置(与手性中心距离远近及空间排列),紫外吸收光谱等。
第二步:“想”
由于CLEC是在反相模式中通过配位交换相互作用进行手性识别而拆分光学物质,因此,在了解待测物化学结构信息后,需尽可能预判该化合物在水溶液或含一定比例有机溶剂的水溶液中的溶解度(涉及到样品进入手性柱后能否“出得来”);该化合物与金属离子形成配位络合物的能力(关乎于样品进入手性柱后是否“分得开”);该化合物的热稳定性如何,比如在50 oC、.60oC条件下是否稳定等(牵涉到样品进入手性柱后出来得能否“尽量快”)。
第三步:“做”
对于具体的待分析样品和已选定的手性柱,分离分析方法的建立与开发主要依赖于流动相条件和/或柱温。
样品准备
对于手性分析而言,样品必须尽可能地“干净”,通常要求其化学纯度在90%以上。具体到CLEC,待测物在流动相中必须有一定的溶解度且越大越好,无机盐及较样品极性小的杂质应尽可能地少。与RP-HPLC一样,尽量用流动相溶解样品。
流动相
配体交换型手性柱,经常采用含一定摩尔浓度二价金属离子的水溶液(或添加有甲醇、乙腈、异丙醇等有机溶剂的金属离子水溶液)为流动相,其中最常用的是CuSO4水溶液。方法建立过程中可以通过改变中心金属离子的种类及浓度、调节流动相pH值、优化有机改性剂类型及添加量和柱温调节等来优化分离方案。需要特别注意的是流动相中必须含有中心金属离子(通常是铜离子)以确保手性柱固定相上的金属离子不至于流失,以维持柱稳定性。
柱温
使用配体交换型手性柱,柱温通常是方法建立需要考虑的首要问题。从手性分离机理来看,待测物与手性固定相 (CSP)、中心金属离子三者形成配位络合物(非对映体复合物),由于非对映体络合物相对结合强度(相对稳定性)不同而致使表现出对映体的分离。因此,对所有配体交换型手性柱的分离,都要考虑温度的影响。而且,柱温与柱压密切相关。在较高温度下进行分离,可缩短分析时间,降低柱子反压。与此同时,在分离过程中高温有可能导致异构体互变,若两对异构体峰中间的基线升高很可能是由于手性异构体之间的相互转变所致。
柱维护
手性柱使用过程中,应严格遵循制造商提供的有关有机改性剂类型和浓度的建议,否则可能会导致柱失效。避免使用含有强保留性组分的样品,建议在手性柱前使用手性预柱加以保护。若由于柱污染而出现峰形变差(前延或严重拖尾)时可考虑更换预柱或用制造商指定的最强洗脱溶剂冲洗色谱柱使其恢复。
系统化方法建立及分离条件优化策略
如前面所述,使用配体交换型手性柱分离氨基酸及其结构类似物等对映体,其色谱保留和选择性可通过改变中心金属离子的种类及浓度、调节流动相pH值、优化有机改性剂类型及添加量和柱温调节等来控制。当使用这些柱进行方法建立时就涉及到手性柱选择、初始流动相条件、柱温参数等问题。CLEC配体交换手性柱通常使用CuSO4水溶液作为流动相,Cu2+浓度控制在0.2mM-3mM之间,且增加Cu2+浓度可以缩短样品的保留时间;加入有机改性剂(如乙腈、异丙醇、甲醇)可以缩短样品的保留时间,提高出峰对称性。 理论上讲只要待测物结构中含有两个合适位置的极性基团,且能够与铜离子发生配位络合作用,配体交换柱柱就应该能够成功地进行手性分离。
采用配体交换型手性柱的方法建立,首先应根据样品结构(亲水性、疏水性)将其归类,然后选择相应的方法建立策略。在方法建立时,样品的溶解度是一个重要参数。
对在反相模式中配位交换手性分离,初始实验时推荐使用下面的方法建立方案:
4.1. 中心金属离子的影响 在选定手性柱的前提下,中心金属离子是决定手性分离选择性的根本因素。通常采用1.0 mM·L-1 CuSO4水溶液或者含一定比例有机改性剂的2.0 mM·L-1 CuSO4水溶液(比如2.0 mM·L-1 CuSO4 含10%CH3CN 的水溶液)。某一具体实验时最适Cu2+浓度应该在0.2mM-3mM之间优化。
4.2. 温度的影响 待测物、手性固定相、中心金属离子Cu2+三者所形成非对映体配合物的相对稳定性在分离中有重要作用且受温度的影响。初始实验时,色谱柱柱温保持恒定在50 oC。柱温最高不超过60 oC。
4.3. 有机改性剂的影响 若样品溶在水中不能澄清透明,呈浑浊状(待测物分子结构中含疏水性取代基),则考虑在流动相(CuSO4水溶液)中添加一定浓度的有机改性剂。比如在2.0 mM·L-1 CuSO4水溶液中添加10%CH3CN(体积比)。加入或增大乙腈、异丙醇、甲醇等有机改性剂浓度可缩短样品的保留时间,提高出峰的对称性。乙腈、异丙醇、甲醇等用量不超过15%(体积比)。
4.4. 流动相pH对分离的影响 对于胺、强酸(多个羧基)类化合物,若手性选择性低且弱保留,可以考虑用冰醋酸或氨水调节流动相pH。配体交换型手性柱在流动相pH 4.5~7.0范围内稳定。
4.5. 检测 UV 254nm处检测。
Chiral HPLC作为一种分离分析技术,与普通液相类似,最常用的检测器为光电二极管阵列检测器(PDA/DAD)。(非芳香性)氨基酸等由于没有明显的发色基团,常规液相分析在靠近UV末端吸收处190~210nm检测。手性配体交换色谱分离过程中,由于与铜离子形成络合物,在254nm有特征吸收,因此,非衍生化的游离氨基酸及其结构类似物可以在UV 254nm处检测。
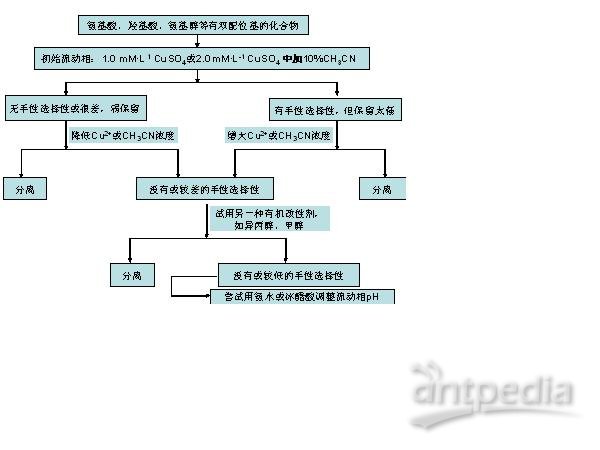
采用配体交换型手性柱进行分离流动相组成调节的优化策略
5. 具体操作说明
关于流动相的配制,比如1.0 mM·L-1 CuSO4水溶液,即准确称取无水硫酸铜0.1596g(CuSO4 分子量:159.61)溶解于1 L水中,摇匀,0.45um滤过即可。这个比较简单,通常不会有什么问题。或者用五水硫酸铜来配制亦可。
诸如含10%CH3CN(体积比)的2.0 mM·L-1 CuSO4水溶液作为流动相,这个具体操作起来有两种方法:方法一:二元泵,一个溶剂通道(A)为2.0 mM·L-1 CuSO4水溶液,另一个溶剂通道(B)为CH3CN,利用泵的精密控制混合功能,A:B=90:10在线混合。方法二:走单泵,分析者按照预定设想手动混合配制流动相,即先准确称取定量的无水硫酸铜溶于900 mL水中,使其完全溶解,然后边摇边缓慢加入100 mLCH3CN(水与乙腈混合,体积改变忽略不计)。这两种方法各有利弊:方法一两相在线混合,有利于方便有机改性剂种类及浓度的调整,但同时在线混合时有金属离子在泵头析出的风险;方法二事先人工手动预混合,金属盐首先全溶于水,再加入有机溶剂,金属离子析出的可能性完全可控,但有机溶剂添加量调整不便,若改性剂用量改变,则流动相需要重新配制。
总结
手性配体交换色谱法是目前分离氨基酸、羟基酸、氨基醇、二肽、糖类、核苷、核苷酸及衍生物等带有双配位基的手性化合物最有效的方法之一。在选定配体交换型手性柱后,方法建立过程中可通过改变金属离子的种类及浓度、调节流动相pH值、优化有机改性剂类型及添加量和柱温调节等来优化分离,以拓展手性柱的使用范围。
 引用
删除
q_r_epcnge / 2010-01-09 20:48:11
引用
删除
q_r_epcnge / 2010-01-09 20:48:11

 引用
删除
haohaorenjia / 2010-01-09 20:01:33
引用
删除
haohaorenjia / 2010-01-09 20:01:33
 引用
删除
haohaorenjia / 2010-01-09 20:01:18
引用
删除
haohaorenjia / 2010-01-09 20:01:18
 引用
删除
JJSIE--NNE / 2010-01-09 11:13:35
引用
删除
JJSIE--NNE / 2010-01-09 11:13:35














