1.概述
元素的相对原子质量是元素的平均原子质量与核素(核素是指具有相同数目质子和相同数目中子的一类原子)12C原子质量的1/12之比。用符号Ar(E)表示。A表示原子(atom),r表示相对(relative),说明元素的原子质量是相对的,E表示元素(element)。相对原子质量是无量纲的量。过去称相对原子质量为原子量,目前仍有用此名称的。从19世纪初道尔顿发表第一张原子量表,迄今已有一百多年的历史,在这期间许多化学家致力于元素原子量的测定工作,尝试过多种方法,上世纪和本世纪初主要利用化学分析方法。自1919年Aston F.W.(阿斯顿)创制质谱仪,并随着质谱仪的不断改进,利用质谱仪能精确测定元素相对原子质量,因此质谱法已逐渐取代化学法。
国际纯粹和应用化学联合会(IUPAC,International Union of Pure and AppliedChemistry)的下设机构无机化学部,设有原子量和同位素丰度委员会(Commisson onAtomic Weights and Isotopic Abundances),此委员会每两年发表一次报告书和Ar(E)表。报告书中说明变更某些元素相对原子质量的原因,解释或给出原子量的定义等。
本实验是利用化学法测定Ar(Mg),原理如下:
金属镁能与HCl反应,置换出氢气:
Mg+2HCl→MgCl2+H2↑
一定质量mMg的镁条与过量的稀HCl作用,在一定温度和压力下,测量被置换出的氢气体积V,由理想气体方程式可算出氢气的物质的量nH2:

式中pH2为氢气分压(单位Pa),R为摩尔气体常数R=8.314J/(mol·K),T为实验时的绝对温度(单位K)。由于
nH2∶nMg=1∶1

镁的摩尔质量MMg的数值即为它的Ar(Mg)。
2.实验要求
(1)测定镁的相对原子质量。
(2)学习测量气体体积的方法。
(3)熟练理想气体状态方程式和分压定律的应用。
(4)练习分析天平称量和使用气压计。
3.实验内容
(1)了解光电天平的简单结构及使用方法。
(2)用分析天平准确称取镁条。
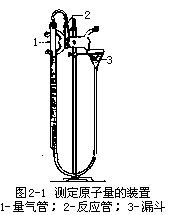
(3)按图2-1装好仪器装置。
(4)往量气管中装水,至水面略低于刻度“0”。上下移动漏斗,以除去附着在量气管和橡皮管内壁的气泡。然后把连接试管和量气管的橡皮塞塞紧,检查仪器装置是否漏气。具体操作是,将漏斗往下移动一段距离,固定在某一位置上,如果量气管内的水面只在开始时略有下降,然后维持不变,说明装置不漏气,如果液面一直下降,表明仪器装置是漏气的。需检查各接口处是否严密,直至装置不漏气为止。
(5)取下试管,量取2mL 6mol·L-1HCl,把玻璃漏斗插入试管中,把HCl由漏斗加入试管,将用水润湿过的镁条贴在试管上部,要使镁条不与酸接触,装好试管,把橡皮塞塞紧,再检查一次装置是否漏气。
(6)移动漏斗使与量气管的液面保持在同一水平上,记下量气管内液面的位置。将试管底部略微抬高(勿使管口的橡皮塞松动)。使管内的盐酸与镁条接触,产生的氢气进入量气管中,为了避免量气管内的压力太大,当管内水面下降时,漏斗也跟着向下移动,使量气管和漏斗中的水面大体保持在同一水平面。
反应完毕,使漏斗与量气管的液面保持在同一水平面,记下液面位置,等1—2min,再记录一次液面位置,如此重复这一操作,直至前后两次记录的液面位置相差不超过0.1mL,表明管内氢气的温度已与室温一致,液面位置读数可用于室温下氢气的物质的量的计算。记下室温和大气压。
(7)用另一片镁条重复上述操作。
4.数据记录

5.思考题
(1)分析实验中可能引起误差的原因是哪些?
(2)反应过程中,如果由量气管压向漏斗的水过多而溢出,对实验结果有无影响?



