
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
FOOD RES INT |福建农林大学应用LCMS/MS代谢组学研究AOS-iron对缺铁性贫血大鼠的代谢作用
编者按
本篇小鹿推出运用LCMS/MS代谢组学对缺铁性贫血的研究。缺铁性贫血(IDA)是一个世界性的营养问题。但目前IDA的代谢机制尚不清楚。本篇探讨补充琼脂低糖铁复合物(AOS-iron)对IDA大鼠的代谢机制。
前言
2020年,福建农林大学食品科学学院课题组在Food Research International杂志发表题为“Metabolic effect of AOS-iron in rats with iron deficiency anemia using LCMS/MS based metabolomics”的研究论文,该研究报道了AOS-iron通过调节代谢紊乱有效治疗IDA。本文作者通过运用LC-MS/MS代谢组学方法,通过测定血清和肝脏内源性代谢物的变化,探讨补充琼脂低糖铁复合物(AOS-iron)对IDA大鼠的代谢机制。

英文标题:Metabolic effect of AOS-iron in rats with iron deficiency anemia using LCMS/MS based metabolomics
中文标题:应用LCMS/MS代谢组学研究AOS-iron对缺铁性贫血大鼠的代谢作用
材料:雄性Sprague-Dawley大鼠
影响因子:4.18
发表期刊:Food Research International
主要运用生物技术: LC-MS/MS代谢组学技术
研究背景
铁是人体的一种微量元素,在各种代谢和生命活动中都是必不可少的,如氧转运、髓鞘形成、DNA合成、神经递质合成和代谢。缺铁会导致各种含铁酶活性下降,进而导致氧代谢水平和免疫水平下降,以及各种代谢紊乱。长期缺铁可严重消耗体内铁元素,导致缺铁性贫血(IDA)。
近年来,一些新的铁补充剂(如多糖-铁配合物、肽-铁配合物、铁纳米复合材料和富马酸亚铁)得到了研究。但目前IDA的代谢途径及补铁治疗IDA的代谢机制尚未见报道。
作者通过研究IDA在大鼠体内的代谢途径,以及一种新型螯合铁补充物——琼脂低聚糖铁络合物(AOS-iron), 能否将IDA中断的相关代谢途径中的主要代谢物恢复到正常水平,从而达到补铁的效果。本研究首次应用血清和肝脏代谢组学研究了IDA大鼠的代谢途径和治疗机制。
研究思路

研究方法
1. 实验分组
①将36只雄性大鼠基础饮食5天后,随机分为正常对照组(12只)和模型组(24只),正常组喂食根据美国AIN93标准生产的正常饲料(45mgFe/kg饲料),模型组喂食低铁饲料(12 mgFe/kg日粮。
②4周后,24只大鼠分为贫血模型组和AOS-iron组,每组12只。AOS-iron组灌胃2 mg /kg·bw AOS-iron溶液+低铁食物;贫血模型组灌胃等量生理盐水+低铁食物;正常对照组灌胃等量生理盐水+正常对照食物,均喂食4周。
③用10%水合麻醉大鼠,心脏穿刺采血。将血液转入不添加任何添加剂的采血管,低温超速离心法提取血清,并置于- 80°C进行代谢分析。全鼠切除肝组织,用0.9%生理盐水清洗肝脏以清除残留血液,并置于- 80°C进行代谢分析。
2.检测方法
① 随机抽取血清和肝脏各8份,100μL血清,加入10μL L-2chloro-phenylalanine(0.3mg/mL,甲醇配置),加入300μL甲醇(V:V=2:1),涡旋、超声后,静置后离心取上清进行LC-MS/MS检测。
②30mg肝脏样本,加入2粒小钢珠,加入20μL L-2chloro-phenylalanine(0.3mg/mL,甲醇配置),加入400μL甲醇-水(V:V=4:1),研磨2分钟后,涡旋、超声,静置后离心取上清进行LC-MS/MS检测。
实验结果和讨论
1.基于LC-MS代谢组学和多变量分析方法,确定AOS-iron有效缓解了IDA大鼠的症状
为了研究添加AOS-iron后,能否将IDA中断的相关代谢途径中的主要代谢物恢复到正常水平,从而达到补铁的效果,作者采用了PCA分析法,结果显示如图1:血清和肝脏中,与正常组相比,贫血模型组大鼠血清和肝脏内源性代谢物的聚类发生了显著变化。补充AOS -iron后,IDA大鼠血清和肝脏代谢变化为正常,说明AOS-iron有效缓解了IDA大鼠的症状。
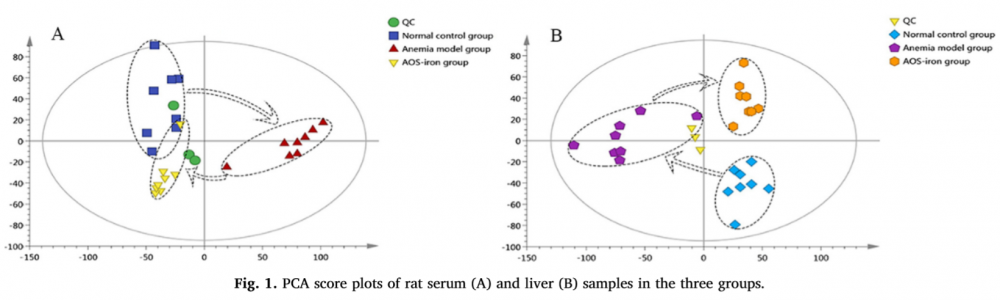
图1 | 三组大鼠血清和肝脏中的PCA图
2.LC-MS代谢物的多元分析模型统计
为了进一步验证代谢谱在对照组、贫血模型组和AOS-iron组之间的分离情况,作者分别针对血清和肝脏在不同条件下的生化差异进行了LC-MS代谢物的多元分析模型统计。结果显示如表1:血清和肝脏中,对照组、贫血模型组和AOS-iron组R2>0.5,说明OPLS-DA模型建立良好。
表1 |三组大鼠血清和肝脏中PCA和OPLS-DA的R2X、R2Y和Q2

从OPLS-DA图中,无论是对照组还是模型组(图2A和C),还是模型和AOS-iron组(图2B和D),血清和肝脏样本都被完全分离,进一步表明血清和肝脏的代谢特征存在显著差异。

图2 | 三组大鼠血清和肝脏中的OPLS-DA图
3.在血清和肝脏中筛选和鉴定潜在的生物标志物
通过与LipidMaps、KEGG和HMDB数据库的比较,21个血清代谢物和12个肝脏代谢物被鉴定为潜在的生物标志物,并在热图中显示出来(图3)。本研究表明用AOS-iron处三组大鼠血清和肝脏中的OPLS-DA图理IDA大鼠后,IDA影响的大多数潜在生物标志物水平恢复到正常或接近正常水平。与正常组比较,血清中,SM(d18:0/ 16:1(9Z))、葡萄糖醛酸内酯在贫血模型组明显降低,其余19种代谢物明显升高;AOS-iron组代谢产物水平均恢复正常。同样,在肝脏中,贫血模型6种代谢物(二十二碳五烯酸、棕榈酸、亚油酸、肝糖胆酸、4-雄烯二醇和17. -羟基孕烯烯酮)水平显著高于正常组,其余6种代谢物水平显著低于正常组。除二十二碳六烯酸外,AOS-iron组代谢产物水平均恢复正常。

图3 | 三组大鼠血清和肝脏中生物标志物的热图分析
4.三组大鼠血清和肝脏中生物标志物的热图分析
利用KEGG数据库进行代谢途径富集分析,探讨IDA期间AOS-iron对潜在生物标志物的代谢机制。在血清的主要代谢途径中,发现17个关键的重要代谢物,如表2:与正常组相比,贫血模型组SM (d18:0/16:1 (9z) 9水平降低,二十碳四烯酸、二十二碳六烯酸, 二十碳二烯酸,亚油酸,棕榈酸,硬脂酸, 顺式- 8,11,14 -二十碳三烯酸,d-erythro-sphinganine,葡糖神经酰胺(d18:1/16:0) d-erythro-sphingosine-1phosphate, 3-O-sulfogalactosyl-ceramide (d18:1/18:0), PC(16:1 z (9) / P18:0), PE (18:2 (9 z, 12 z) / 24:1 (z) 15z),PA (16:0/16:0) LysoPC(18:0)和palmitoylcarnitine都增加了。与贫血组相比,这些关键的重要代谢物被恢复到正常水平。
表2 |常见途径的差异蛋白质和代谢物

在肝脏的主要代谢途径中,发现8个关键的重要代谢物,如表3:与正常组相比,贫血模型组的二十二碳六烯酸、潘泰因、谷胱甘肽和甘油磷酸胆碱水平显著降低,而二十二碳五烯酸、棕榈酸、亚油酸和糖胆酸水平显著升高。此外,与贫血模型相比,除二十二碳六烯酸外,AOS-iron组的关键重要代谢物均恢复到正常水平。
表3 |三组大鼠肝脏样本中的显著代谢物

研究结论
之前的研究表明,与葡萄糖酸和FeSO4相比,AOS-iron对IDA大鼠有更好的补铁效果。在本研究中,我们进一步研究了IDA大鼠和AOS-iron处理大鼠血清和肝脏代谢物的变化。共鉴定了血清和肝脏中的22种内源性代谢物作为IDA大鼠体内的潜在生物标志物以及相关代谢途径,如图4所示:包括饱和脂肪酸和不饱和脂肪酸的生物合成、鞘脂类代谢、甘油磷脂代谢、亚油酸代谢、FcγR-mediated吞噬作用、胰腺癌的新陈代谢、自噬调节、促性腺激素释放激素信号通路、脂肪酸代谢,泛酸酯和生物合成,谷胱甘肽代谢和初级胆汁酸的生物合成。AOS-iron恢复的主要代谢物(二十碳四烯酸、二十二碳六烯酸, 二十碳二烯酸,亚油酸,棕榈酸,硬脂酸, 顺式- 8,11,14 -二十碳三烯酸,d-erythro-sphinganine,葡糖神经酰胺(d18:1/16:0) d-erythro-sphingosine-1phosphate,3-O-sulfogalactosyl-ceramide (d18:1/18:0), PC(16:1 z (9) / P18:0), PE (18:2 (9 z, 12 z) / 24:1 (z) 15z),PA (16:0/16:0) LysoPC(18:0)、棕榈酰肉碱,二十二碳五烯酸,磷酸潘泰因4 ' -磷酸,谷胱甘肽,甘油磷酸胆碱,糖胆酸)可使IDA干扰相关通路的主要代谢物恢复正常水平。
潜在的生物标志物和主要的生化途径的鉴定不仅为IDA大鼠的AOS-iron干预提供了进一步的有价值的证据,而且有助于改善IDA的治疗策略,在未来开发新的铁补充物。

图4 | IDA和AOS-iron处理相关代谢途径示意图
小鹿推荐
本研究首次应用血清和肝脏LC-MS/MS代谢组学研究了IDA大鼠的代谢途径和治疗机制,通过添加AOS-iron,查看IDA中断的相关代谢途径中的主要代谢物能否恢复到正常水平。缺铁性贫血(IDA)是一个世界性的营养问题,本文使用LC-MS代谢组学方法研究AOS-iron对IDA的影响的研究方法,十分值得借鉴。
部分文献参考
1.Aktas, M., Elmastas, M., Ozcicek, F., & Yilmaz, N. (2016). Erythrocyte membrane fatty acid composition in premenopausal patients with iron deficiency anemia. Journal of Oleo Science, 65(3), 225–231.
2.Babu, G. N., Gupta, M., Paliwal, V. K., Singh, S., Chatterji, T., & Roy, R. (2018). Serum metabolomics study in a group of Parkinson's disease patients from northern India. Clinica Chimica Acta, 480, 214–219.
往期回顾
●客户文章|Environ. Sci. Technol.南京大学赵丽娟教授用代谢组学揭示暴露于CeO2纳米颗粒的菠菜植物的隐形响应
●开年客户文章解读 |Microbiome(IF=10.465)运用GC-MS非靶标代谢组学研究植物根际微生物对开花时间的影响
●组学研究,R语言实用技巧—热图,运用pheatmap包简单易懂快速汇图方法来袭~
