
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
客户文章|Environ. Sci. Technol.南京大学赵丽娟教授用代谢组学揭示暴露于CeO2纳米颗粒的菠菜植物的隐形响应
编者按
目前,运用代谢组学的研究方法探究纳米材料对植物影响机制的研究屡见不鲜,鹿明生物针对此类型的客户文章在2019年也获得不少客户的认可,在继EST客户文章 | 南京大学赵丽娟教授课题组运用GC-MS代谢组学揭示黄瓜应对银纳米粒子诱导的氧化应激代谢重构研究、客户文章 | 在模拟生理环境中通过蛋白冠装饰的超顺磁性纳米粒子靶向电荷介导的癌细胞、客户文章解读 | 代谢组学揭示土壤中工程纳米材料暴露会改变土壤根际代谢物特征和玉米代谢途径...之后,鹿明生物助力此类型地文章研究脚步也在逐渐加快...
本篇小鹿带来鹿明生物合作客户南京大学环境学院文章,研究纳米材料对植物的影响有助于更好地理解CeO2 NPs引起的植物的内在表型和代谢组变化。
前言
本文为鹿明生物合作客户南京大学环境学院污染控制与资源再利用国家重点实验室赵丽娟教授团队在Environmental Science & Technology期刊(IF=7.149)发表的 “代谢组学揭示暴露于CeO2纳米颗粒的菠菜植物的隐形响应”的文章,通过整合表型和代谢组学分析,研究了氧化铈纳米粒与菠菜之间的相互作用。发现在表型特征没有变化的情况下,不同剂量的CeO2 NPs均可诱导叶和根的代谢重构,同时叶与根中的微量金属元素含量下降,这篇文章的结果有助于更好地理解引起的植物的内在表型和代谢组变化。

英文标题:Metabolomics Reveal the “Invisible” Responses of Spinach Plants Exposed to CeO2 Nanoparticles
中文标题:代谢组学揭示暴露于CeO2纳米颗粒的菠菜植物的“隐形”响应
材料:菠菜叶片和根
影响因子:7.149
发表期刊:Environmental Science & Technology
主要运用鹿明生物技术: GC-MS非靶标代谢分析
研究背景
在农业中工程化纳米颗粒(NP)具有良好的前景,因为其具有模拟抗氧化酶活性的作用,也可以增加光合作用并改善胁迫耐受性。镧系金属氧化物纳米颗粒CeO2 NPs表现出优异的清除活性氧(ROS)的活性,可保护植物的光合作用免受氧化胁迫并改善植物的生长性能。了解CeO2与植物生理生化功能之间相互作用的机制对于其在农业中的可持续应用至关重要,但目前尚不清楚CeO2 NPs调节植物的代谢机制。基于“组学”的研究(例如转录组学,蛋白质组学和代谢组学)可以提供有关植物对NP响应的详细和全面的信息。作者通过使用基于气相色谱-质谱(GC-MS)的代谢组学方法,深入地了解植物对CeO2 NPs的响应机制,对于其可持续应用和安全设计至关重要。
研究思路

研究方法
1. 实验材料准备
菠菜种子种植于有机盆栽土壤中,并在在温室中于白天在25°C和晚上20°C下培养28天。28天后,每周两次用叶面喷施CeO2 NPs(10和100 mg / L,0.3和3 mg /植物,总量),每周两次,在喷洒时土壤被覆盖。
2.检测方法
(1)生理生化分析
叶绿素a、b和类胡萝卜素的测定、酚类化合物总含量测定、测量离子渗漏量(略微修改)评估膜的完整性、硫代酸反应性物质(TBARS)测定法测量脂质过氧化标记物丙二醛(MDA)的含量。
(2)金属含量测定
电感耦合等离子体发射光谱法(ICP-MS)对Ce,K,Na,Mg,Ca,Mn,Fe,Cu和Zn进行分析。
(3)叶和根代谢物的测定:GC-MS非靶标代谢分析
(4)总RNA提取和抗氧化酶基因表达分析
实验结果和讨论
1.光合色素和叶绿素荧光结果
暴露3周后,所有植株均未显示毒性症状(图1A),且对照植物和CeO2 NPs暴露植物之间的叶绿素a,b和类胡萝卜素水平无显著差异(图1B)。叶绿素荧光参数,被用作光系统II效率的指标。在暴露的三周期间,每个植株均检测叶绿素荧光和电子传输速率。作者发现首次和二次在叶面喷施后,与对照相比,低剂量的CeO2 NPs(0.3mg/株)暴露后ΦII均显著降低(t-tes,p <0.05),表明有应激反应;高剂量暴露首次喷施后,相对于对照也有显著变化。但在第3次喷施后直至收获前,处理过的CeO2 NPs与对照组没有明显差异,表明植物通过某种未知机制适应或应对了CeO2 NPs暴露。这些数据表明,在测试浓度下,CeO2 NPs导致了光合作用系统的早期响应,但是它不会显著影响植物功能。

图1 |(A)菠菜照片和(B)菠菜叶中光合色素含量
将4周龄的菠菜植株叶面暴露于不同剂量的CeO2 NPs(0,0.3和3 mg /株)持续3周。数据是五次重复的平均值。误差棒代表标准偏差。相同的字母表示无统计学差异(p≤0.05)。
2.细胞膜完整性和抗氧化剂
测试中使用的CeO2NPs直径非常小(平均大小4 nm),相对容易通过表皮或气孔进入细胞内空间,从而诱导细胞膜周围的氧化应激。但实验结果发现离子泄漏没有增加,表明对叶细胞膜没有损害(图2A)。相反低剂量的CeO2NPs暴露(p≤0.05)可减少电解质渗漏,这是膜完整性的指标,有利于植物抗逆性(图2A)。这些结果与某些文献报道不一致。产生不同结果的原因可能是由于颗粒大小和剂量,叶的结构不同也可能导致性能不同。此外发现MDA含量没有显著影响(图2B),表明CeO2NPs暴露未发生脂质过氧化。总酚含量也没有变化(图2C)。暴露3周后,CeO2NPs也未改变叶片新鲜生物量(图2D)。表型、生理和生化结果综合表明,尽管暴露于CeO2NPs(0.3和3 mg /植物),导致菠菜幼苗PSII量子产率和电子传输速率的早期响应,但并未诱导任何胁迫反应,并且不会影响植物生物量。
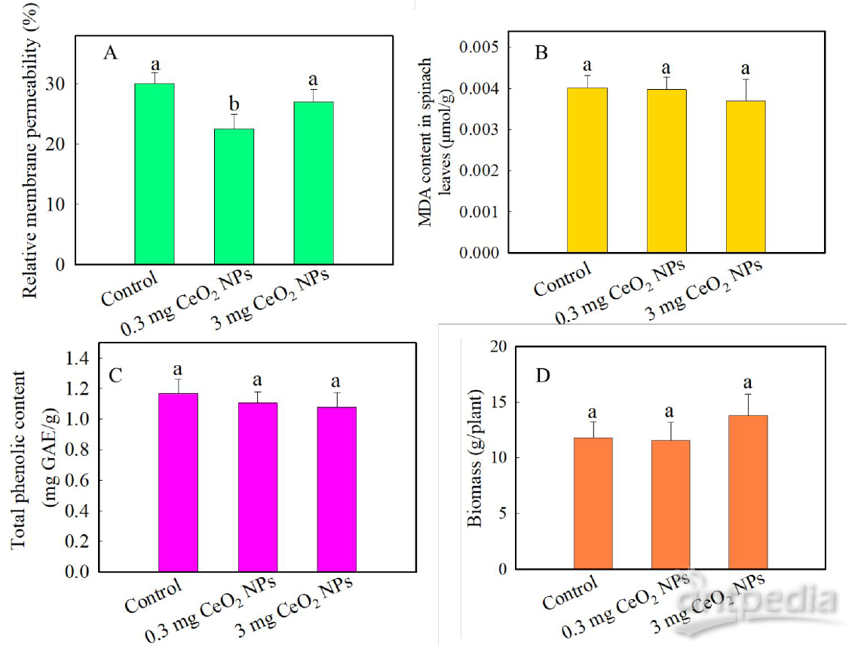
图2 | 持续3周暴露于不同剂量的CeO2NPs(0,0.3和3 mg /株)的菠菜叶
(A)相对膜渗透性;
(B)脂质过氧化;
(C)总抗氧化剂含量;
(D)生物量;
数据是五次重复的平均值。误差棒代表标准偏差。不同字母代表统计学差异,p≤0.05
3.铈和组织中的其他矿物质的含量
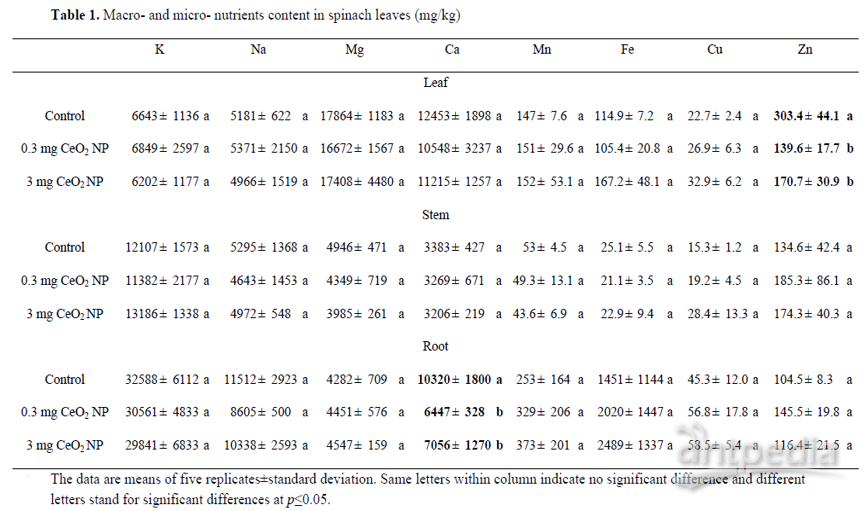
ICP-MS数据显示,暴露3周后菠菜叶片中Ce的生物累积量分别为1.3±1.1、127±41和916±108 mg / kg干重,分别对应着0、0.3和3 mg CeO2NPs,作者推测叶面喷洒的CeO2NPs仍保留在细胞壁之外,并且它们可能对细胞之间的ROS信号传递事件产生影响。CeO2NPs可进一步进入韧皮部,被转运到根部。但作者发现对照和CeO2NPs处理植物的根中Ce含量没有差异,表明纳米粒子没有向根部转移,与之前的一些报道结果不一致。纳米粒子的结构特性(例如大小和电荷)可能是控制其通过植物细胞壁运输的驱动因素。
ICP研究结果表明,与对照相比,暴露于0.3 mg和3 mg CeO2 /植物的植物叶片中锌含量显著降低,需要进一步研究以阐明不同物种和纳米颗粒之间的不同吸收机制(表1)。相反在两个剂量的CeO2NPs暴露下,根中锌含量均保持不变。这表明叶面喷洒CeO2NPs抑制了锌在叶片中的积累,而不是吸收。另一个有趣的发现是,在低和高剂量CeO2NPs接触下,根中的Ca含量分别显著降低38%和32%(表1)。CeO2NPs影响Zn和Ca积累的原因仍然未知,需要进一步研究以阐明其机理。
表1 |菠菜叶中的常量和微量营养素含量(mg / kg)
4.菠菜叶片的代谢轮廓谱
使用GC-MS非靶标代谢组学技术在菠菜叶中鉴定并定量了305种代谢物。通过单方差分析筛选出菠菜叶显著变化的代谢物,作者发现在CeO2NPs暴露下,菠菜叶中305种代谢产物中有6种发生显著变化,包括吡啶、柠康酸、β-羟基酸、三氯酚、双甘油和果糖。值得注意的是,大多数显著变化的代谢物仅在较低CeO2浓度的植物中才能观察到。主成分分析(PCA)得分图显示低浓度组与对照组、高浓度组显著分离,与单方差分析结果一致。该结果表明,与高浓度相比,低浓度的CeO2NPs引起的叶片代谢组变化更大。通过PLS-DA模型VIP得分和t检验p值筛选的显著变化的代谢物,按照类别进行讨论:
(1)氨基酸:在低剂量CeO2NPs暴露下,包括天冬酰胺、天冬氨酸、谷氨酰胺、L-半胱氨酸、蛋氨酸在内的许多氨基酸增加了28〜958%(图3A)。氨基酸在调节植物生理过程中起着重要作用,例如充当渗透剂调节离子迁移、调节气孔开放、充当防御相关代谢产物和信号代谢产物的合成前体。半胱氨酸和蛋氨酸是含硫的氨基酸,在植物起到必不可少的作用。谷氨酸和天冬氨酸是氮同化的调节剂。因此氨基酸含量的变化可能表明初级氮代谢受到干扰。
(2)碳水化合物:与氨基酸不同,蔗糖、果糖、1-磷酸葡萄糖、左旋葡聚糖、核糖-5-磷酸、阿洛糖和木糖等多种碳水化合物的水平显著降低(图3 B)。碳水化合物为植物的正常生长和发育提供能量,并充当信号分子,还充当蛋白质、脂质和代谢沟通的桥梁。低剂量和高剂量的CeO2NPs分别使蔗糖减少38.8%和33.3%,另一种可溶性糖果糖分别减少44.4%和39.2%。氨基酸的上调和糖的下调表明低剂量的CeO2NPs影响菠菜叶中氮和碳池的重新分配。
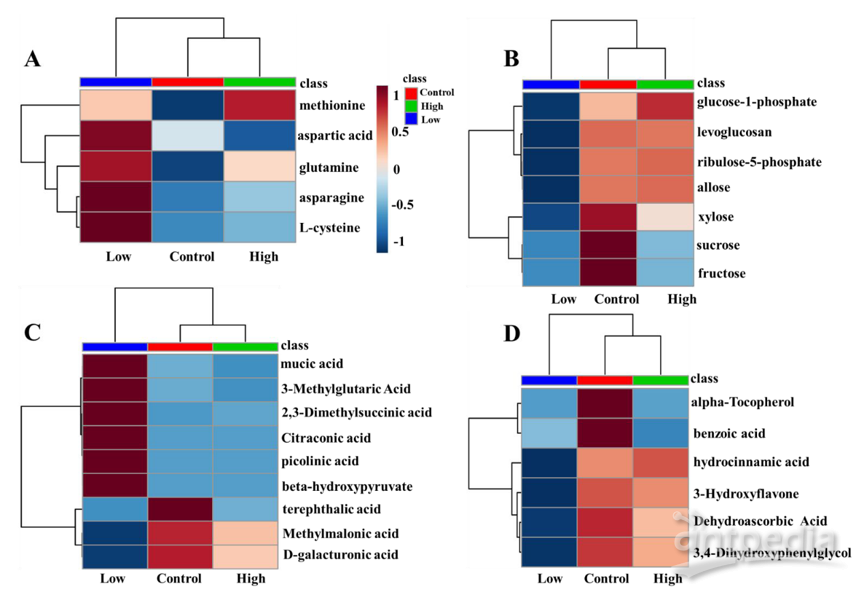
图3 | 持续3周暴露于0.3 mg /植物CeO2NPs的菠菜叶代谢产物的显著变化热图
三个拟南芥品系在WM和PM处理组接种后(n = 12),(A)N含量(NH4+);
A氨基酸; B糖; C有机酸; D酚类;
Low-低浓度(0.3 mg /株),hight-高浓度(3 mg /株),control- 对照(0.3 mg /株)
(3)有机酸:值得注意的是某些有机酸(、3-甲基戊二酸、2,3-二甲基琥珀酸、柠康酸和吡啶,β-羟基酸)具有相同的模式,其中相对浓度降低是由于低浓度的CeO2NPs引起的(图3 C)。已发现吡啶具有许多生物学功能,其中之一是诱导水稻防御相关基因并随后增强对稻瘟病真菌的抗性。先前的研究表明,有机酸和氨基酸在调节金属离子从根到叶的运输以及在叶中的积累中也起着重要作用。
(4)抗氧化剂:与对照相比,在低浓度的CeO2NPs条件下,具有清除ROS能力的代谢物(例如α-生育酚,脱氢抗坏血酸,3-羟基黄酮,氢肉桂酸,3,4-二羟基苯基乙二醇)减少了27-79%(图3D)。在两种剂量的CeO2NPs下,α-生育酚均降低,它是叶中主要脂溶性抗氧化剂。与对照相 比,抗坏血酸的氧化形式脱氢抗坏血酸(DHA)显著降低了59%(p = 0.003)(图3D)。另外3-羟基黄酮、氢肉桂酸和3,4-二羟基苯基乙二醇(DHPG)是重要的酚类抗氧化剂,在叶绿体中充当叶绿体包膜的单线态氧清除剂和稳定剂。由于叶面施用的CeO2NPs表现出清除•O2-的能力,因此作者推测CeO2NPs的SOD模拟活性可保护菠菜植物的内源性非酶抗氧化系统。
5.菠菜叶中抗氧化酶基因的表达
除低分子量抗氧化剂化合物外,抗氧化剂酶在ROS猝灭中也起着重要作用。是植物防御系统的重要组成部分。作者检测了6个抗氧化剂相关基因的表达,包括铜/锌超氧化物歧化酶(Cu / Zn-SOD)、过氧化氢酶(CAT)、谷胱甘肽S-转移酶(GST)、谷胱甘肽过氧化物酶(GPx)、抗坏血酸过氧化物酶(APX)和使用RT-qPCR的单脱氢抗坏血酸还原酶(MDAR)。外源抗氧化剂CeO2NPs使SOD基因表达水平保持不变, APX、CAT略有增加,但GPX、MDAR和GSTU17酶保持不变,CeO2NPs对所有研究的抗氧化酶的表达几乎没有影响。
6.菠菜根的代谢谱变化
在菠菜根部鉴定并定量了208种代谢物。使用无监督的PCA模型,对照组和CeO2NPs处理组也能很好地分开,表明各组之间的代谢产物存在显著差异。这也表明尽管根未直接暴露于CeO2NPs且Ce不会从叶转移到根,但更明显的代谢变化发生在根部而不是叶部。有监督的PLS-DA模型也得到类似的结果,但与叶片不同,在高CeO2NPs浓度下,根部代谢产物发生的变化更大。在PLS-DA得分图的第二主成分(PC2)方向,低浓度与对照组和高浓度组分离,表明某些代谢变化是低剂量CeO2NPs特有的。
(1)氨基酸和含氮代谢物
通过VIP评分(大于1)和t检验(p <0.05)筛选差异代谢物,大多数代谢物在暴露于CeO2NPs后以剂量依赖的方式减少。值得注意的是,在高CeO2NPs下,包括谷氨酸、天冬氨酸、天冬酰胺、酪氨酸、色氨酸、L-半胱氨酸、蛋氨酸、环亮氨酸和苏氨酸在内的许多氨基酸均显著降低(图4)。谷氨酸参与调节植物氨同化作用,它的减少可能意味着通过谷氨酰胺合成酶/谷氨酸合酶途径的氮吸收能力降低。另外硫酸以剂量依赖的方式减少,并且在较高NPs浓度的植物中未检测到。这可以解释两个含S氨基酸(蛋氨酸和L-半胱氨酸)减少的原因。蛋氨酸转化为S-腺苷-1-蛋氨酸(SAM)后,可控制几种必需代谢物的表达水平,包括,多胺,生物素和植物铁载体。此外SAM还调节重要的过程,例如叶绿素,细胞壁的形成,以及许多次生代谢产物的生物合成。高剂量的CeO2NPs降低了多种氨基酸的含量,但苯丙氨酸含量明显增加(图4)。苯丙氨酸是多种中间和次生代谢产物的前体,在植物防御中起重要的作用。苯丙氨酸的上调可能表明菠菜对NPs的胁迫反应。除氨基酸外,在高剂量的CeO2NPs暴露的菠菜根也降低了其他含氮化合物,例如3-羟基降碱、S-羧甲基半胱氨酸、α-氨基己二酸、烟酰甘氨酸和氨基甲酰天冬氨酸。高剂量组的氨基酸同时下调的原因尚不清楚,一种假设是许多氨基酸的下调可能表明植物中合成代谢向分解代谢的转化。这意味着潜在的植物生长迟缓。另一个可能是CeO2NPs破坏了氮的吸收并因此影响了氨基酸的合成。氨基酸的减少可能会损害蛋白质的生物合成并影响植物的生长,需要长期的暴露实验证实。
(2)脂肪酸
除氨基酸外,两种脂肪酸(包括硬脂酸和棕榈酸)在高剂量组分别增加了5倍和3倍,尽管不饱和脂肪酸和花生四烯酸含量减少。脂肪酸代谢谱的变化可能表明菠菜根重构了膜的流动性,这可能是植物防止Ce或CeO2NPs从叶向根移位的一种主动策略。
(3)糖类和有机酸
暴露于高剂量CeO2NPs的菠菜根部,包括3,6-脱水D-半乳糖、葡萄糖-1-磷酸葡萄糖、赤藓糖和麦白糖显著降低。许多有机酸也显著,例如2-呋喃酸、2-甲基富马酸、柠康酸、马来酸、苏糖酸和乙醇酸。有机酸是植物细胞中主要碳代谢(光合作用和呼吸作用)的中间体,代表固定碳的暂时或存储形式,在维持氧化还原平衡、ATP的生产和消耗、质子的支持中起重要作用。因此CeO2NPs暴露下有机酸分布变化的机制是多种代谢途径重构的结果。
(4)其它代谢物
作者观察到几种木质素,例如1,2,4-苯二酚、3-羟基苯、4-羟基苯、烟酸与CeO2NPs呈剂量依赖性。木质素是细胞壁的组成部分。木质素减少可能表明细胞壁组成发生变化。此外在高剂量的CeO2NPs存在下,胸腺嘧啶、尿嘧啶、核糖醇和核糖减少,单核苷酸胞苷一磷酸(CMP)(CyO2NPs)也呈剂量依赖性减少。一些代谢产物与CeO2NPs呈剂量依赖性增加,例如龙胆二糖、麦芽三糖、5-磷酸核糖、异肌醇苏糖醇、草酸和蔗糖,而吲哚乳酸和苯丙氨酸仅对高剂量的CeO2NPs响应。这些代谢物中的一些可能充当信号传导和防御分子,例如糖、异肌醇、苯丙氨酸和草酸。

图4 | 暴露不同剂量CeO2NPs的菠菜根的TCA循环和氨基酸生物合成途径示意图
浓度0、0.3和3 mg /株植物,箱图表示暴露于0.3和3 mg /植物CeO2NPs的菠菜植物中显著变化的氨基酸的相对丰度。方框图中的A、B和C代表不同剂量的CeO2NPs(0、0.3和3 mg /植物)
7.菠菜叶和根中的扰动生物途径
生物途径分析的结果表明,低剂量的CeO2NPs会扰乱四条生物途径,包括甘氨酸、丝氨酸和苏氨酸代谢,酪氨酸代谢,氨基糖和核苷酸糖代谢以及糖酵解或糖异生。相反高剂量的CeO2NPs仅诱导一种生物学途径(氨基糖和核苷酸糖代谢)干扰(图5A)。在根部,低剂量的CeO2NPs干扰了两条生物途径,包括异生物碱的生物合成和酪氨酸代谢(图5B)。两种防御和信号相关途径的激活表明低剂量的CeO2NPs刺激了菠菜防御系统。这可能有助于暴露于低剂量CeO2NPs的菠菜根保持氨基酸水平。不同的是,高剂量的CeO2NPs(3 mg /植物)在菠菜根中引起了8条生物途径扰动,包括丙氨酸-天冬氨酸和谷氨酸代谢,甘氨酸-丝氨酸和苏氨酸代谢,硫代谢,精氨酸和脯氨酸代谢,赖氨酸的生物合成,半胱氨酸和蛋氨酸的代谢,色氨酸代谢,缬氨酸-亮氨酸和异亮氨酸的生物合成(图5B)。除硫代谢外,几乎所有扰动的途径都与氮代谢有关。这一发现与先前的讨论一致,即低剂量的CeO2NPs会引起主动防御反应,但不会下调生物途径,而高剂量的CeO2NPs会扰乱菠菜根中的氮代谢。尽管暴露是通过叶面喷施,但在未直接暴露于NPs的根组织中也观察到了明显的代谢变化。结果还表明,与表型参数(如生物量和叶绿素含量)相比,定量小分子代谢物的变化是研究植物对NPs响应的敏感终点。

图5 | 暴露于0、0.3和3 mg /株CeO2 NP的菠菜叶和根的被扰动生物途径的维恩图
研究结论
在这项研究中,4周龄菠菜暴露于植物实验室合成的CeO2NPs中,暴露时间为3周,剂量分别为0、0.3和3 mg / 植物。作者测定了光合作用,生物量和脂质过氧化等参数,应用GC-MS代谢组学测定了叶片和根中的数百种低分子量代谢物,作者发现,代谢组学揭示了植物对CeO2NPs的隐形反应。尽管低剂量组没有表现出表型参数的变化,但菠菜叶中存在明显的代谢重构。当以每株3 mg的剂量施用时,CeO2NPs会抑制根部的氮代谢。另外两种浓度CeO2NPs的喷施,都会影响叶中锌和钙的吸收。
小鹿推荐
本文阐明纳米颗粒和植物之间的相互作用机制对于其在农业安全和可持续使用非常重要。作者通过表型分析与代谢分析相结合,深入了解CeO2NPs与植物之间的相互作用,不仅研究了叶片在暴露于CeO2NPs时代谢组的变化,同时也研究了根部受到的影响。所获得的结果对于从事纳米材料对植物影响研究具有重要的价值,也为其它环境胁迫下的植物代谢组学研究提供借鉴和参考。
部分文献参考
1. White, J. C.; Gardea-Torresdey, J., Achieving food security through the very small. Nature Nanotechnology 2018, 13, (8), 627-629.
2. Walker, G. W.; Kookana, R. S.; Smith, N. E.; Kah, M.; Doolette, C. L.; Reeves, P. T.; Lovell, W.; Anderson, D. J.; Turney, T. W.; Navarro, D. A., Ecological Risk
Assessment of Nano-enabled Pesticides: A Perspective on Problem Formulation. Journal of Agricultural and Food Chemistry 2018, 66, (26), 6480-6486.
3. Giraldo, J. P.; Landry, M. P.; Faltermeier, S. M.; McNicholas, T. P.; Iverson, N. M.; Boghossian, A. A.; Reuel, N. F.; Hilmer, A. J.; Sen, F.; Brew, J. A.; Strano, M. S.,Plant nanobionics approach to augment photosynthesis and biochemical sensing. Nature Materials 2014, 13, 400.
4. Wu, H.; Tito, N.; Giraldo, J. P., Anionic Cerium Oxide Nanoparticles Protect Plant Photosynthesis from Abiotic Stress by Scavenging Reactive Oxygen Species. ACS Nano 2017, 11, (11), 11283-11297.
