
分析测试百科网 认证会员,请放心拨打!
超高分辨率让“不可能”变为“可能”!

史晓磊
Isotope Abundance
同位素丰度,是指自然界中存在的某一元素的各种同位素的相对含量(以原子百分计)。如1H的同位素丰度为99.985%,2H为0.015%。可用于追踪物质的运行和变化规律,借助同位素原子以研究有机反应历程的方法,称之为同位素示踪法。因其所引用的同位素标记化合物的化学量是极微量的,不会对体内生理过程产生影响,获得的分析结果符合生理条件,在代谢组学研究中被广泛应用。
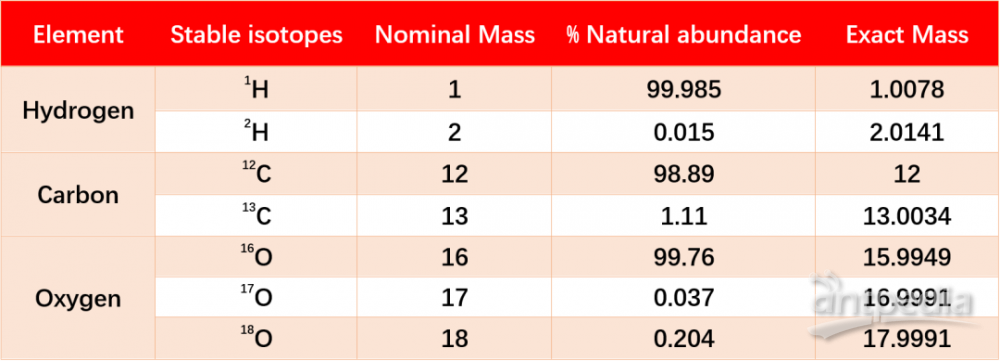
想在不受13C干扰的条件下去测量低丰度的2H示踪以用于代谢研究,是几乎不可能的,由于来自四极杆质谱的M+1质量同位素13C丰度很高,约为 18%,严重干扰了测定2H的标记示踪[1]。但实际上,2H(0.015%)的低自然丰度使得示踪剂剂量在理论上小于0.5%是可能的[2],这需要极高分辨率的质谱才能实现完全的基线分离,而Orbitrap Exploris GC 240出现之后,凭借其240000的超高分辨率,让以往在代谢研究中不可能实现的难题变为可能。
今天为大家分享一篇美国德克萨斯大学西南医学中心的研究人员利用Orbitrap Exploris GC 240分析棕榈酸中的2H同位素示踪剂的应用。
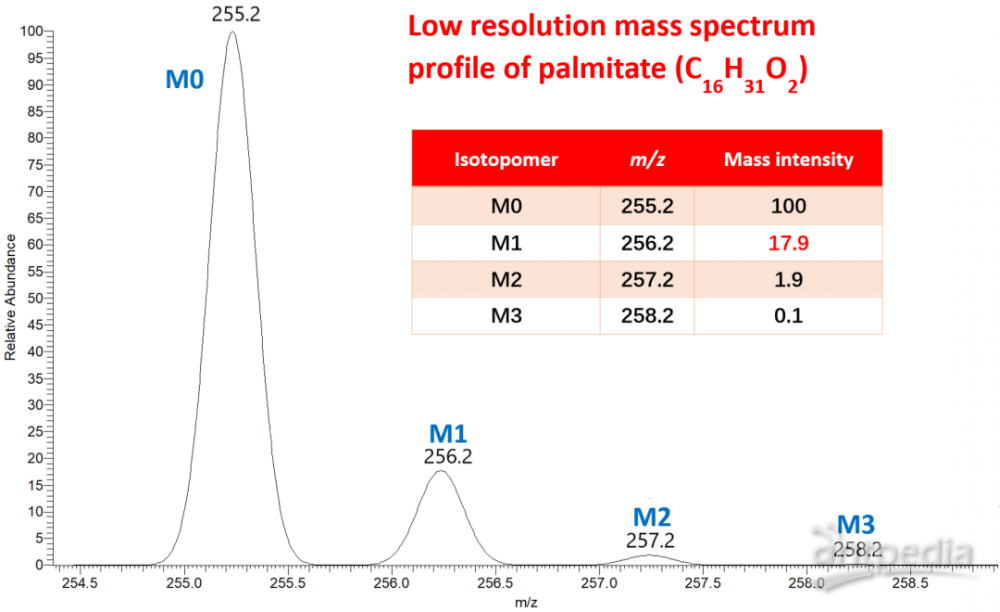
图1.棕榈酸酯C16H31O2的质量同位素分布

摘要
新生脂肪生成(De novo lipogenesis, DNL)是由碳水化合物等非脂质营养物质合成的脂肪酸,是长期储存热量和维持细胞膜的主要营养物质[3]。监测DNL在细胞器、细胞、组织活检、小鼠模型和人类等环境中的功能,将有助于发现新的分子生理学和许多不同疾病的潜在干预措施。DNL通量通常通过氘水(2H2O)给药后2H掺入脂肪酸来测量。本文利用GC-Orbitrap解析2H和13C脂肪酸质同位素,允许DNL定量使用较低的2H2O剂量和较短的实验周期。
New
Orbitrap Exploris™ GC 240
科研利器,引领潮流

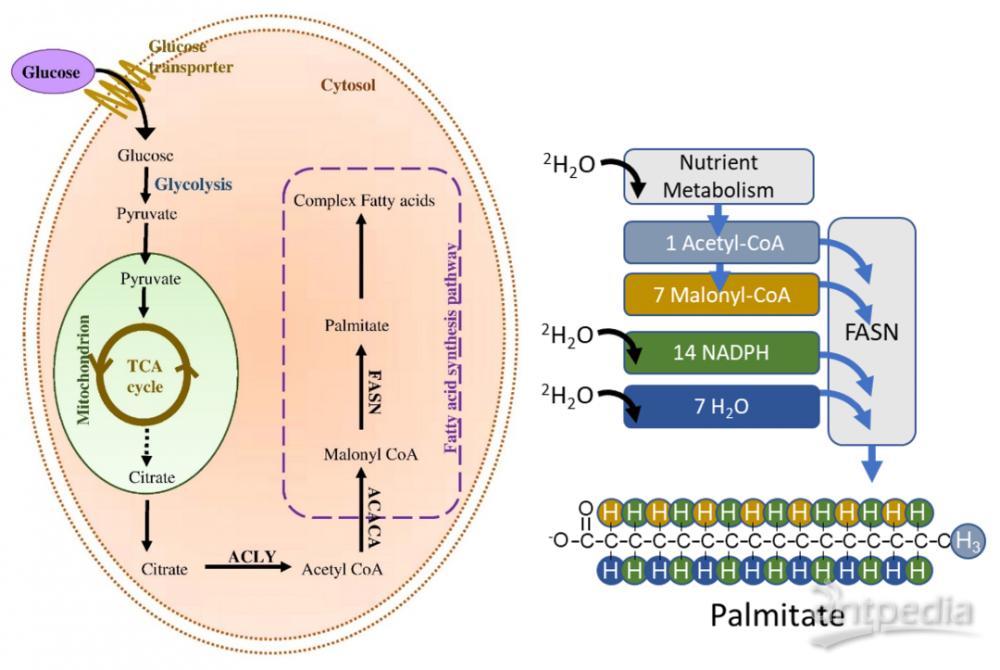
图2. 稳定同位素2H2O是测定DNL的基础
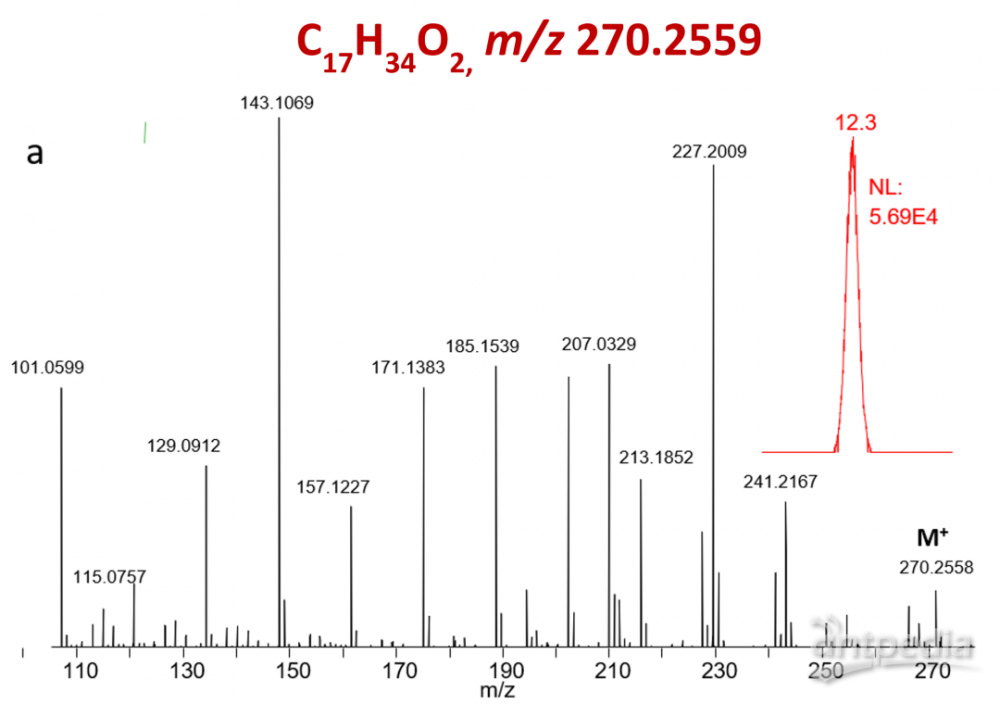
图3.EI模式下的棕榈酸甲酯的质谱图
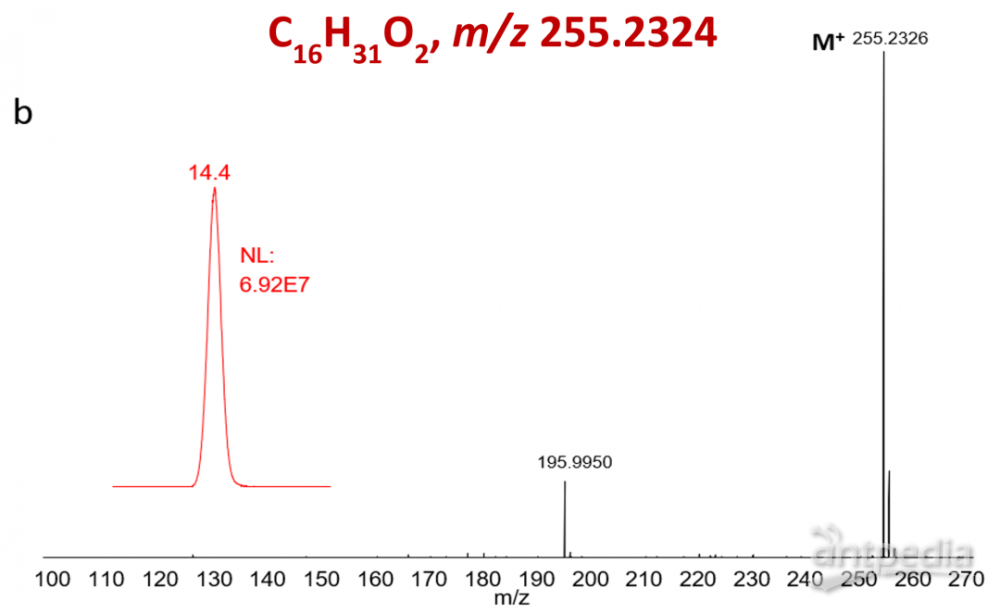
图4.NCI模式下的棕榈酸五氟苯酯质谱图
通过比较棕榈酸甲酯在EI模式和五氟溴代苯衍生棕榈酸酯在NCI模式下的质谱图,NCI测定五氟苯酯产生了未破碎的棕榈酸盐离子(C16H31O2,精确分子量为255.2324),比EI检测甲酯的效率和灵敏度高1000倍(见图3和图4)。
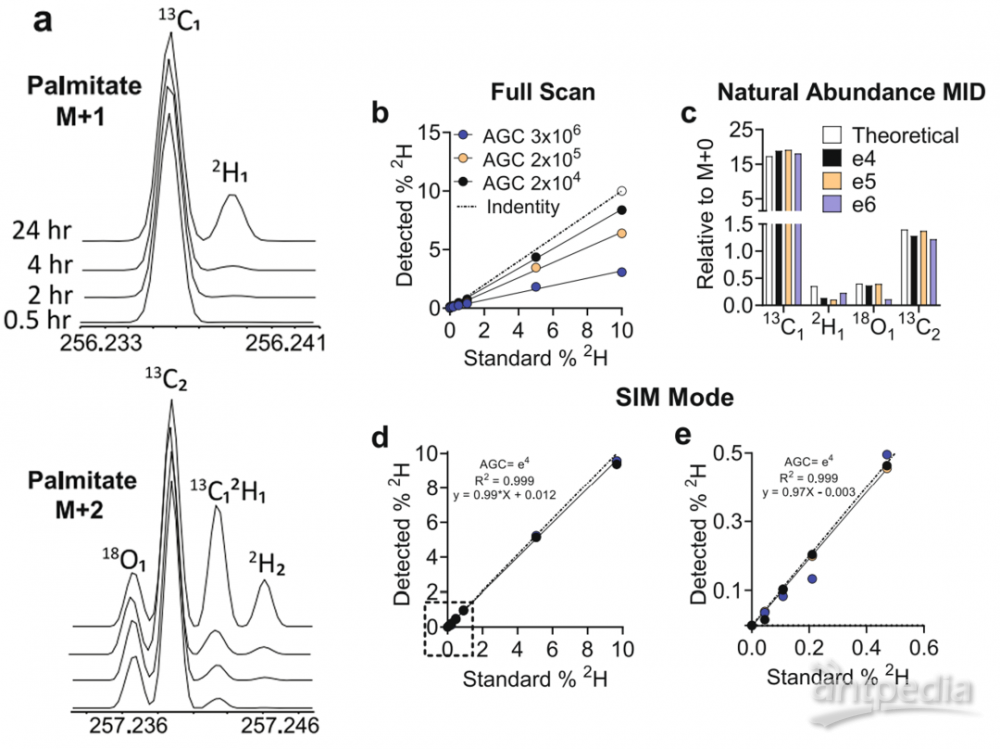
图5. 采用不同条件验证2H在棕榈酸中的示踪标记
针对不同AGC(自动增益控制)目标的靶向选择离子监测(Target-SIM)(2*104, 2*105和3*106),2H1和13C1的M + 1两种方法都能很好地分辨。而但全扫描数据为易受离子损失,特别是在AGC目标值高的情况下,容易产生空间电荷效应。同时,准确度高(94-107%),精度高(变异系数<10%)[5-6],Target-SIM在定量时是更为合适的采集模式。
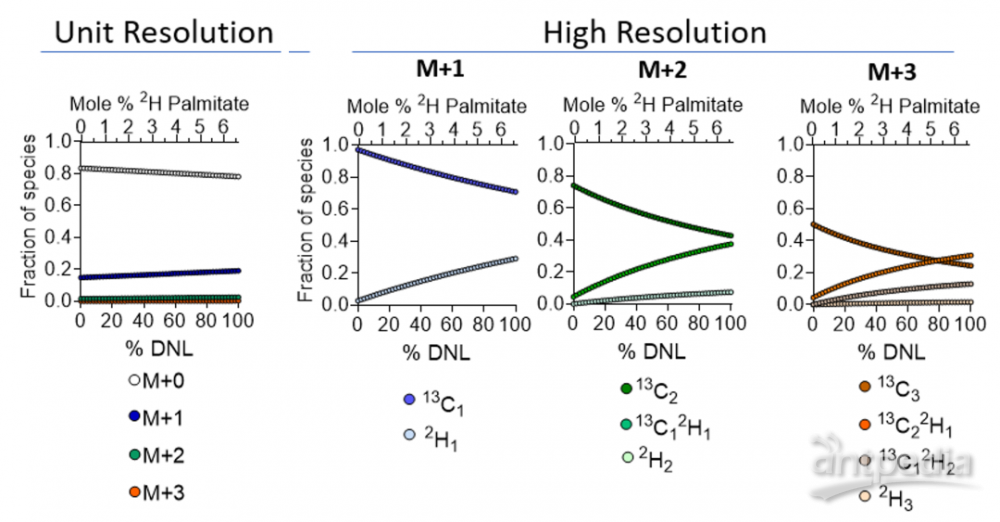
图6.模拟人体水富集到0.3% 2H2O时棕榈酸质量富集作为DNL的函数研究
棕榈酸酯13C1和2H1 (M + 1)质量位移需要用165,000的最小分辨率进行分辨,以往用傅立叶变换离子回旋共振质谱法(FT-ICR-MS)可以实现,但扫描时间长,并需要超导磁体[7],不易实现。当GC-Orbitrap商业化之后,成为很多代谢组学实验室进行分辨13C和2H的首选。
为了确定这种方法是否比单位分辨率的质谱更有优势,模拟了超高分辨率的质谱0-10%的DNL分数范围和0.3%的体内水富集。结果证明,GC-Orbitrap为检测极低前体和产物富集的DNL提供了主要的理论优势。
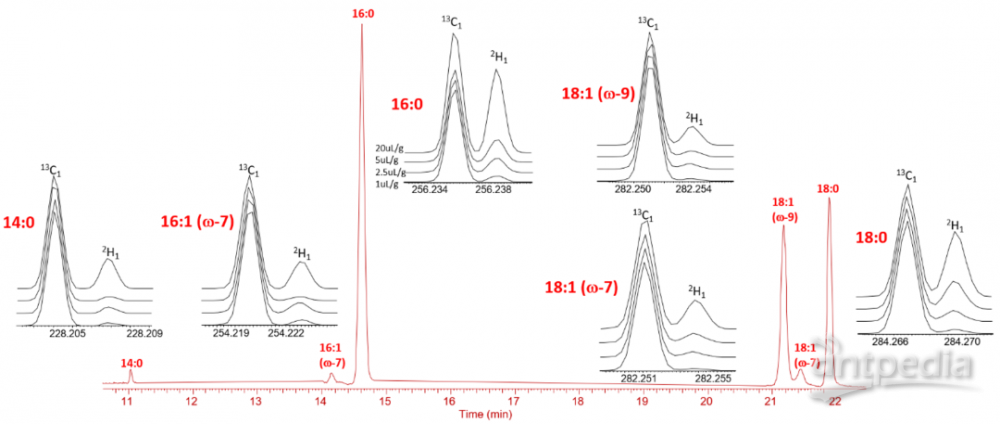
图7. 在其他脂肪酸中也可以检测到2H富集
结论
本文介绍了一种HR-Orbitrap-GC-MS方法,该方法解决了其他同位素的2H质谱富集,来研究DNL生成。在棕榈酸中直接检测2H质量同位素可防止在低富集时与13C自然丰度的卷积,实验证明,DNL可以在1小时内检测完成,且2H2O的剂量比以前更低[8]。Orbitrap Exploris GC 240因其超高的24万分辨率解决了代谢组学研究中一直以来的难题,成为代谢组学研究中不可或缺的利器。

参考文献:
1. Brunengraber, H., Kelleher, J. K. & Des Rosiers, C. Applications of mass isotopomer analysis to nutritional research. Annu. Rev. Nutr. 17, 559 (1997).
2. Diraison, F., Pachiaudi, C. & Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water:
3. Wallace, M. & Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Semin Cell Dev Biol, https://doi.org/10.1016/j.semcdb.2020.02.012 (2020).
4. Murphy, E. J. Stable isotope methods for the in vivo measurement of lipogenesis and triglyceride metabolism. J. Anim. Sci. 84, E94–E104 (2006).
5. Su, X., Lu, W. & Rabinowitz, J. D. Metabolite spectral accuracy on orbitraps.Anal. Chem. 89, 5940–5948 (2017).
6. Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F. & Brunengraber, H.Correction of 13C mass isotopomer distributions for natural stable isotope abundance. J. Mass Spectrom. 31, 255–262 (1996). determination of the average number of deuterium atoms incorporated. Metabolism 45,817–821 (1996).
7. Herath, K. B. et al. Determination of low levels of 2H-labeling using highresolution mass spectrometry: application in studies of lipid flux and beyond.Rapid Commun. Mass Spectrom. 28, 239–244 (2014).
8. Previs, S. F. et al. Using [(2)H]water to quantify the contribution of de novo palmitate synthesis in plasma: enabling back-to-back studies. Am. J. Physiol.Endocrinol. Metab. 315, E63–E71 (2018).

| 标签: | 色谱 |


