
全能核酸酶-病毒纯化及检测利器不容错过!
全能核酸酶,又称非限制性核酸内切酶,是一种来源于Serratia Marcescen的非特异性核酸内切酶,可以降解各种形式的(双链,单链,线状,环状,天然或变性)DNA和RNA,产生3-5个碱基长度的5'-单磷酸寡核苷酸。无论是实验研究,还是工业生产,全能核酸酶都是目前唯一能够同时有效去除DNA和RNA的酶。另外,全能核酸酶在非常广泛的条件下(6M urea,0.1 M Guanidine HCl,0.4% Triton X100,0.1% SDS,1 mM EDTA,1 mM PMSF)都能保持很高的稳定性和消化活力,非常适用于作为各类科学研究以及疫苗、蛋白、多糖类制药工业的首选酶制剂,去除样本或制品中的核酸残留,提升样本纯度和制品生物功效。
随着越来越多的生物制品(重组蛋白、Vero细胞疫苗、细胞治疗/基因治疗药物等)进入治疗领域,生物制品的质量控制也日趋严格,其中核酸残留是各类质控标准的重中之重,因为DNA较好的稳定性,容易在生产过程中形成残留,而这些生物制品应用到人类疾病预防和治疗时,会带来不可控危险因素。终产品的宿主核酸残留量必须遵循WHO、FDA和EMEA以及我国NMPA监管条例。尤其近年来包括大牌进口产品在内的狂犬疫苗DNA残留超标问题,引起了社会和业界的广泛关注。WHO和各国药物监管机构一般将疫苗等生物制品的残留DNA控制在100pg/剂量,特殊情况下最高允许10ng/剂量。我国参照WHO、FDA和欧盟标准,在药典中对生物制品的核酸残留量有明确规定。药典中明确规定酵母、大肠杆菌表达的生物制品中DNA残留量不超过10ng/剂量。我国2020年药典将人用狂犬病疫苗(Vero细胞)DNA残留标准更新为≤3ng/剂量。本产品无动物源性, 无氨苄青霉素,可高效降解单链、双链、线性、环状、超螺旋等任何形式的DNA及RNA。
一,产品应用范围
1)用于除去生物制品中的DNA/RNA
美国FDA对治疗用每剂量的生物制品的核酸含量要求为低于10 pg,国内对此相应的要求为低于100 pg。全能核酸酶可用于疫苗、多糖、蛋白等工业生物制品中核酸的去除,使生物制品的最终核酸含量符合要求,同时提高生物制品功效。
2)用于降低细胞破碎后的粘度
全能核酸酶可以降解所有形式的核酸,降低细胞裂解液的粘度,提高蛋白得率,改善分离效果,使之易于过滤(尤其是超滤),利于下游层析纯化操作。
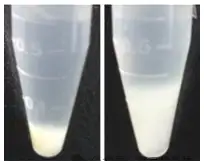
图2 细胞裂解液全能核酸酶处理(A)和未处理(B)比较图
3)用于细胞培养来源产物的纯化过程
核酸很容易粘附在病毒样颗粒(VLP)、病毒粒子、包涵体等细胞生成颗粒的表面,使颗粒大小或电荷发生改变,造成这些颗粒的聚集,如外周血单细胞(PBMC)存放过程中的结块现象。全能核酸酶可有效降解核酸,避免核酸对细胞产物的影响以及纯化效率,利于提高细胞产物纯化效率。
4)用于生化分析样品的制备
在ELISA、色谱分析、双相电泳和足迹分析等过程中,用全能核酸酶处理含有核酸的蛋白样品,可提高分辨率,并提高回收率。
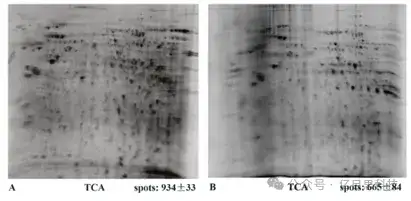
图3 小鼠脑核蛋白全能核酸酶处理(A)和未处理(B)双向电泳比较图
二,质量控制
1.宿主蛋白残留:酶联免疫检测试剂盒未检测到宿主蛋白。
2.蛋白酶残留:250KU/mL 的全能核酸酶与底物反应 60min,未检测到活力。
3. 细菌内毒素(Endotoxin):LAL-Test,中国药典 2020 版第四部凝胶限度试验法通则(1143)。
4.微生物负载:中国药典2020版第四部无菌检查法通则(1101),中华人民共和国国家标准,GB 4789.2-2016。
5. 重金属残留:电感耦合等离子体发射光谱法,HJ776-2015。
三,常见问答
Q.产品按多少比例加入?
A:建议加入比例(终浓度)为1:1000-1:20000,具体需依据反应时间、温度、以及待处理样本中的盐离子浓度。
Q.产品能否可以减少用量?
A:如希望减少用量,需适当延长处理时间。
Q.全能核酸酶的抑制因素有哪些?
A:在含有以下物质的体系中,全能核酸酶的活性会降低50%或以上:>150 mM一价阳离子,>100 mM磷酸盐,>100 mM硫酸铵,>100 mM盐酸胍,>0.1% SDS,>1% Triton X-100,>1% Tween 20。
Q.怎样灭活全能核酸酶?
A:采用EDTA螯合金属离子会可逆地抑制全能核酸酶活性,极端条件会造成不可逆失活,例如100 mM NaOH,70℃处理30 min等。
Q.如何去除处理后样本中的全能核酸酶?
亿目思的全能核酸酶分为无标签、His标签和Strep标签三种版本。若所处理的样本无标签,则可选择带标签的全能核酸酶,通过相应亲和resin去除残留核酸酶;若所处理的样本带有His标签,则可选择无标签的全能核酸酶,通过亲和层析吸附目标蛋白,从而去除残留核酸酶;若所处理的样本是无标签和带His标签的混合蛋白,则可选择带Strep标签的全能核酸酶,通过Strep亲和resin去除残留核酸酶。
Q.全能核酸酶与蛋白酶抑制剂混合物是否兼容?
A:全能核酸酶与不含EDTA的蛋白酶抑制剂混合物兼容。若含有EDTA且浓度>1 mM时,会抑制核酸酶活性,建议:如果必须加EDTA,按照2倍EDTA浓度补加Mg2+。
Q. 如何确认样本中是否还有全能核酸酶残留?
A:可用亿目思的全能核酸酶残留检测试剂盒(Cat.No. 70291)进行鉴定,仅需10分钟即可对样本中的残留核酸酶进行定量鉴定,最低检出限达0.001 ng/mL。
Q.产品的用量是多少?
A:需要根据重悬菌体所需裂解液的体积来确定需要酶的量。若普通蛋白纯化,则需要浓度为25 U/mL;核蛋白则需要100 U/mL;病毒表达蛋白纯化需要浓度为12.5 U/mL;疫苗产品需要量为0.9-1.1 U/mL。具体用量还需要参照待处理样本成分进行调整。
Q.产品的稳定性如何,如果不小心在室温放置几天后,酶活性会受到怎样的影响?
A:室温2-3天,对活力影响不大。
Q.全能核酸酶能在尿素环境消化核酸吗?
A:全能核酸酶在尿素浓度为6 M时活性先增加,随着时间延长活性又有降低;在尿素为7 M时,全能核酸酶15分钟后出现变性并失活。但是在酶失活前多数核酸已经降解了。可通过提高全能核酸酶使用浓度补偿7 M尿素的影响。
四,逐典Pannarase全能核酸酶优势:
1.无动物源性、无氨苄青霉素
2.杰出单位比酶活、更高效的核酸降解能力
3.先进的生产工艺,非传统His标签纯化、排除引入金属离子风险
4.严格的质控标准,内毒水平低,确保单位酶活的准确性以及批次间稳定性
1,全能核酸酶应用条件:
全能核酸酶的酶活会受到多种因素的影响(例如温度、pH、离子强度等),故用量范围也会从0.1 U/mL-250 U/mL不等。因此,不同的操作环境下酶的最佳浓度不同,需要通过实验设置梯度进行最佳条件的摸索。
2,应用实例:
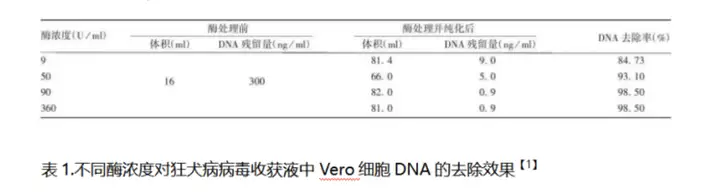
1.样品:狂犬病毒浓缩液
处理条件:核酸酶浓度50~90U/ml ,
37 ℃处理 2 h,转入18 ~ 26 ℃处理 6h
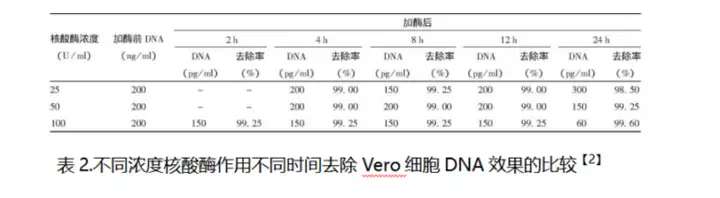
2.样品:狂犬病病毒浓缩液
处理条件:25、50和100 U/ml,37℃
3.样品:流感病毒浓缩液
处理条件:10 U/mL,37℃



