
研究结果
一、基于凝胶验证METAL-TPP鉴定的MBPs
METAL-TPP的假设是基于MBPs会因为金属解离后稳定性发生变化从而通过TPP技术鉴定出来。为了验证这一假设,研究人员选择三个已知的MBPs,山梨醇脱氢酶(SORD)、α-烯醇化酶(ENO1)、凝胶素(GSN)分别结合锌、镁和钙,以及甘油醛-3-磷酸脱氢酶(GAPDH)作为非MBP对照并使用广谱的金属离子螯合剂EDTA进行处理(图1a)。正如预期,EDTA处理后三种MBPs的Tm值均显著向较低温度偏移,而GAPDH的热稳定性没有受到影响(图1b)。结果证实了EDTA是一种有效的螯合剂,可以从MBPs中剥离金属使其结构不稳定。

图1:METAL-TPP的设计与验证
为了进一步测试METAL-TPP是否能在复杂的蛋白质组中起作用,研究人员用EDTA或PBS处理HeLa细胞裂解液,结果再次证明METAL-TPP能够有效地检测金属结合蛋白热稳定性的降低(图1c)。
二、METAL-TPP对人蛋白质组中的MBPs全局分析
接下来,研究人员将基于质谱的TMT定量蛋白质组学技术与METAL-TPP结合来系统分析人蛋白质组中的MBPs(图2a)。结果显示SORD、ENO1、GSN和GAPDH基于质谱鉴定的热稳定性变化与凝胶实验中观察到的热稳定性变化基本一致。生信分析显示有125个蛋白的热稳定性显著降低,其中102个(占比82%)是已知的金属结合蛋白,注释分析显示鉴定的MBPs的金属类型分布与人数据库中注释的MBPs分布无显著差异,表明METAL-TPP对金属类型无偏好性(图2b-e)。并且发现了17个此前未被功能注释的潜在金属结合蛋白(图2f)。

图2:METAL-TPP对人蛋白质组中的MBPs全局分析
三、锌结合蛋白GFPT2的特征分析
17个潜在的MBPs中,谷氨酰胺果糖6-磷酸转氨酶(GFPT2)引起研究人员重视。GFPT1/2 是己糖生物合成途径的第一步限速酶, UDP-GlcNAc 是该通路的最终产物(图3a)。这些蛋白的功能障碍与2型糖尿病以及各种类型的癌症密切相关。因为GFPT1和GFPT2之前没有被注释为MBPs,那么它们是否能结合哺乳动物细胞中的金属并调节酶的功能?研究人员通过一系列实验证明在活细胞水平锌离子会和GFPT2发生相互作用,抑制该蛋白的活性(图3b-c)。同时锌离子的存在会使 UDP-GlcNAc的水平显著降低(图3d),说明锌离子能够通过抑制 GFPT2的活性调控己糖生物合成途径。此外,研究人员还发现GFPT2对锌抑制比GFPT1更敏感(图3e-f)。
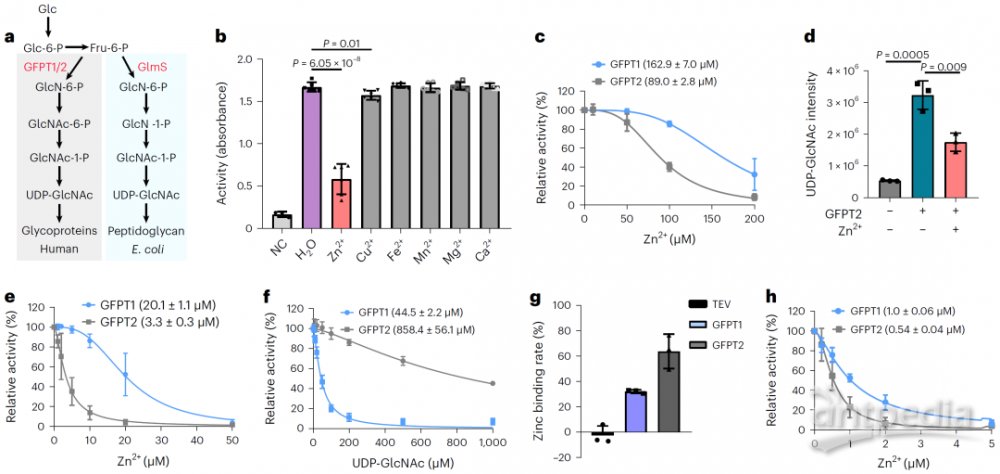
图3:锌能结合并抑制人类的GFPT酶
四、锌结合GlmS的结构和功能表征
研究人员纯化了GFPT2在大肠杆菌中的同源蛋白GlmS,等温滴定量热法(ITC)证明 GlmS是锌离子结合蛋白(图4a)。晶体结构显示GlmS-C的同型二聚体与三个锌离子结合(图4b-d),且其结合位点与Glms与底物果糖6-磷酸的位点靠近(图4f),这是锌可以抑制Glms活性的可能原因之一。

图4:锌结合GlmS的结构和功能表征
五、TPEN用于METAL-TPP分析
除了EDTA外,研究人员还将另一种金属螯合剂TPEN应用于人类蛋白质组,结果显示150个热稳定性降低的蛋白质中有110个为已知金属结合蛋白(图5a),这110个已知的MBPs中有95个(86%)是锌结合蛋白,而基于EDTA的分析中只有41%(102个中的42个)是锌结合蛋白(图5b)。与镁结合的ENO1和钙结合的GSN相比,两种锌结合MBPs(SORD和TRAF2)的热稳定性显著降低(图5c-d)。剩余40个潜在金属结合蛋白中,研究人员选择了其中一个靶点蛋白GPATCH11进行了初步生化验证,发现该蛋白是一个锌离子结合蛋白(图5f)。
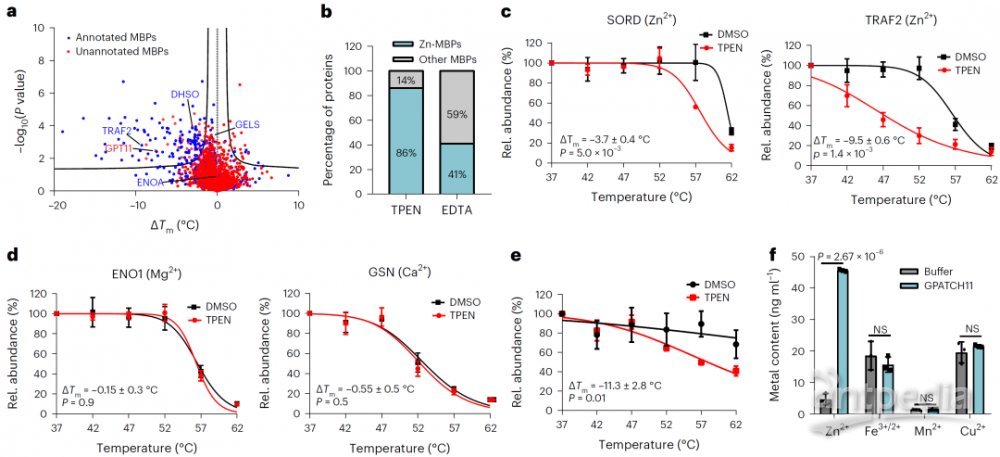
图5:TPEN应用METAL-TPP分析人锌结合蛋白
研究结论
综上,研究人员开发了全新的鉴定金属结合蛋白的方法(METAL-TPP),利用EDTA和TPEN两种不同类型的金属螯合剂对MBPs进行扰动,并结合TPP热蛋白质组学全面探究了人源MBPs。这一创新性方法为深入探究MBPs的功能和机制提供了强有力的工具,并为金属在细胞生物学中的功能研究提供了丰富的资源。
关注青莲百奥










