Nature:如何战胜老年痴呆?有三点需要强调
阿尔兹海默症(AD),一个让全球科学家都为之头疼、叹息的疾病。
目前的研究、医疗水平没有办法预防和治愈它,甚至于我们没有办法减缓它的恶化。作为一种多发于中老年群体的神经衰退性疾病,AD威胁着全球超4400万例患者的健康和生命。2050年患者数量预估将上涨至13,500万例,这无疑意味着超万亿的治疗护理费用需要投入。
2015年12月,美国前国务卿希拉里•克林顿启动阿尔兹海默症研究项目,旨在2026年之前研发出能够治疗甚至治愈阿尔兹海默症的方法。美国前众议院议长Newt Gingrich表示:“如果我们无法控制阿尔兹海默症,它终将吞没掉医疗系统。”
Gingrich强调时间紧迫,因为:医疗资金无法填补患者增长趋势;AD本身很复杂,对其致病机理认知和治疗手段开发都很有限;超200项围绕AD药物的临床试验都失败了。
梅奥诊所的神经学家Ronald Petersen强调:“我们确实需要一次突破。” 过去,近乎99%的临床试验都以失败而惨淡收场,那么1%的胜利势必将带来莫大的希望和信心,这种成功的意义远远超过新药物上市那么简单。
资金:在基础研究领域投入更多的科研经费
在高收入国家,老年性痴呆症是引发死亡的第五大病症,但是它却是最“昂贵”的疾病。作为痴呆症中最常见的疾病,阿尔兹海默症起病隐袭、多发于中老年群体。患者多伴随有智力下降、记忆衰弱、语言退化等典型症状。这意味着患者需要长年的护理。
但是,痴呆症领域的研究经费投入却远远少于其他疾病。例如,美国国立卫生研究院(NIH)2015年拨给痴呆症的研究经费只有约7亿美元,而心血管疾病的经费额度达到20亿美元,癌症的科研经费超50亿美元。
这种“轻视”主要与社会关注度不够有关联,大家更偏向于癌症、艾滋病等重大疾病的防治进展。美国阿尔兹海默症防治协会创始人和主席George Vradenburg认为,阿尔兹海默症之所以未得到重视是因为患者都“躲”起来了。
老年性痴呆症是造成老年人残疾、依赖他人的主要原因之一,但是很多人却将其误解为衰老的正常现象,甚至于将其看作“耻辱”,很少有患者或者家属愿意站出来与外界交流。但是,“年老”≠“痴呆”,相反痴呆症是一种极其复杂的疾病。
庆幸的是,政府及社会对它的关注度正在逐年提升。2008年,法国首先启动一个5年期国家级项目,并投入2.2亿美元。2009年,德国神经衰退性疾病研究中心成立,且每年获资6600万欧元。2010年至2015年间,英国政府对痴呆症的研究投入上涨两倍,达到8200万美元。欧盟每年在痴呆症领域拨款数千万欧元,以促进药物创新和研究合作。澳大利亚同样也设立了5年痴呆症研究基金(1.5亿美元)。
法国里尔大学附属医院神经病学家和遗传学家Philippe Amouyel表示:“这是一个全球性挑战,需要大家合作完成。”
治疗:研发更好的治疗药物
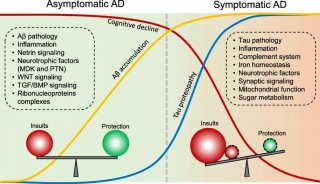
已有研究证实,AD典型的病例特征有两个:老年斑和神经元纤维缠结。其中,老年斑的主要组成物质是β-淀粉样蛋白(Aβ),而神经元纤维缠结主要成分是过度磷酸化的Tau蛋白。因此,由这两个病理分子——Aβ、Tau蛋白衍生的“两大阵营”:Aβ学说和Tau学说,一直是阿尔兹海默症致病机理的争论之处。
制药巨头礼来一直试图“啃下”阿尔兹海默症,其单抗药物Solanezumab目前正处于大型后期临床试验。Solanezumab靶向β-淀粉样蛋白(Aβ),旨在清除患者大脑蛋白病斑。虽然这一药物在前两年已经经历过2次失败,但是礼来认为Solanezuma能够减缓轻度的阿尔兹海默症病情。
如果Solanezumab确实能够延迟大脑衰退,那么它将改善30-40%的认知能力。从学术层面上,Solanezumab的成功将为备受争议的Aβ学说“正名”。
之前很多公司开发的抗Aβ免疫治疗均以失败告终,很多科学家对此提出质疑:Aβ是否是AD的致病物质?不少专家认为,β-淀粉样蛋白是疾病的结果,并不是致病原因。但是,支持Aβ学说的研究者们则认为,药物试验之所以失败,是因为给药太迟,或者患者服药时大脑还没有聚集蛋白病斑。
阿尔兹海默症领域有效治疗药物的空缺和需求显然。除了礼来,百健的aducanumab、罗氏的gantenerumab、罗氏/基因泰克的Crenezumab都致力于清除蛋白病斑,且均处于临床中后期。无论哪一家先行一步,都将填补该领域的空缺。
未来35年,痴呆症患者数量将上涨两倍,低中收入国家将很难填补该领域的医疗需求。数百种临床试验因为没有达到预期疗效而惨淡终止。
预防:在病症出现之前“下手”
尽管淀粉样蛋白假说的争论仍在继续,但是清除蛋白病斑药物作为早期防治措施的热情并没有减轻。
布莱根妇女医院的神经学家Reisa Sperling表示,即便是发病初期都预示着脑细胞衰亡不可挽回。“你可以清除所有的病斑,或者阻止它进一步沉淀恶化,但是却不能挽救已经损伤的神经元细胞。” Sperling解释道。
这也是Sperling团队针对特殊的患者(尚未表现出症状、大脑β-淀粉样蛋白高表达)展开抗Aβ免疫治疗的原因。他们以solanezumab为临床药物,试图验证它对于这一特殊患者的治疗效果。同时,今年3月,Sperling和南加州大学阿尔兹海默症研究中心的神经学家Paul Aisen合作了一个类似的临床试验。他们选取强生的一款抑制Aβ分泌酶的药物,用于验证其早期治疗效果。
这些干预措施被称为“二级预防”,因为它们的目标是大脑已经聚集淀粉样蛋白的患者。Sperling和Aisen计划测试“初级预防”。8月,他们在NIH的资助下开始治疗更为特殊的患者:大脑Aβ表达正常、没有认知衰退迹象,但是考虑到年龄以及携带易感基因,这一特殊人群患阿尔兹海默症的风险较高。
华盛顿大学医学院的神经学家David Holtzman表示:“最大的作为是延缓疾病发生。”
多靶点:Aβ、Tau蛋白和神经炎症
就像胆固醇并不是引发心脏病的唯一原因一样,β-淀粉样蛋白也不是导致AD的唯一致病因素。Tau蛋白会导致大脑神经元纤维缠结。不少制药公司都试图研发致力于清除Tau蛋白的药物,《Science Translational Medicine》期刊最新发表文章揭示,相比于Aβ,Tau蛋白沉积才是在发病初期造成记忆衰退、痴呆等症状的重要“元凶”。
哈佛大学医学院附属麻省总医院的神经遗传学家Rudy Tanzi表示,除了清除Aβ蛋白和Tau蛋白,阿尔兹海默症药物研发的第三个靶点是神经炎症。
Tanzi将阿尔兹海默症比喻成一场大脑的“野火”。其中,蛋白斑块、神经元纤维缠结催生了最初的“小范围火苗”,但是神经炎症导致了“大型火焰”。一旦大火肆虐,仅仅浇灭小火苗已经无济于事。
这一推测也可以解释为什么抗Aβ免疫治疗后期患者无效。对于晚期患者,或许抑制大脑胶质细胞炎症反应会更有所成效,例如有研究团队致力于CD33、TREM2两个基因,它们参与调控胶质细胞功能。
其他干预措施:认知训练……
除了治疗,很多阿尔兹海默症研究专家强调开发低成本干预措施也很重要。
澳大利亚新南威尔士大学的老年精神病学家Henry Brodaty正在验证网络程序(关注饮食、锻炼、认知训练和情绪监控)能否延迟疾病发展。Brodaty表示:“全球2/3痴呆患者发生在发展中国家。所以,相比于昂贵的药物,干预生活方式或许可以给阿尔兹海默症带来意想不到的防治效果。”
来自南弗罗里达大学的心理学家Jerri Edwards团队历时10年发现,认知游戏可以降低阿尔兹海默症发病率。通过游戏,中老年人的认知速度、记忆力和理解力得到训练,这种训练可以降低阿尔兹海默病等痴呆症约50%的发病率。这种风险预控效果远超药物、运动、营养等其他方式。
当然,除了AD,血管性痴呆、路易体痴呆(神经细胞内出现蛋白质异常聚集)和额颞叶痴呆(大脑额叶恶化)也是造成老年痴呆的疾病种类。伦敦大学的神经学家Nick Fox表示,我们不应该忽略其他疾病,因为解决一种,可以为其他疾病提供防治线索。
研究人员表示,药物研发的最大障碍可能是无法招募到足够数量的临床参与者。对此,解决方案之一是临床准备注册中心。在临床实施之前就为感兴趣参加试验的人提供注册平台,从而确保临床试验更快地启动。
加拿大财团投资的COMPASS-ND注册中心专门针对神经衰退性疾病监理,共有1600个人登记在册。麦吉尔大学的神经学家Serge Gauthier表示,招募到合适的受试对象比较困难。大约1/3参与者患有主观认知障碍,但是他们却不符合临床上对痴呆的定义。
总结
阿尔兹海默症领域还有很多难题:β-淀粉样蛋白是否需要完全清楚?导致记忆衰退、认知下降的“元凶”是什么?病毒细菌等感染是否导致AD?……这些谜题的解答势必需要投入更多的精力和资金。
无论是否自愿,我们都需要直面痴呆症,因为患病人数一直在上涨。阿尔兹海默症协会总监Robert Egge强调:“阿尔兹海默症是一个令人担忧的公共健康问题。现在面临的问题是,我们是否走在前面?”
-
产品技术

-
综述