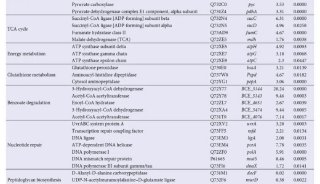
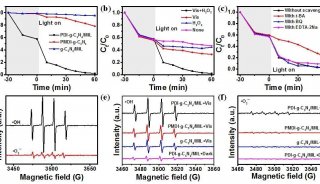
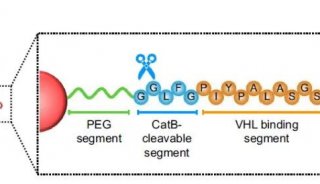
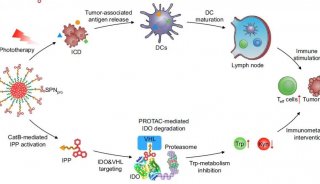
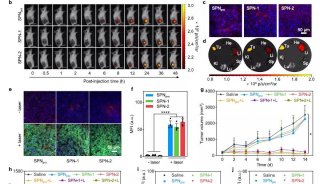
胡红雨课题组JBC解析蛋白调控机制
来自中科院上海生命科学研究院的研究人员,在新研究中证实NUB1L蛋白通过P97UFD1/NPL4复合物促进了将NEDD8运送到蛋白酶体进行降解。这一研究发现在线发表在9月9日的《生物化学杂志》(JBC)上。
领导这一研究的是中科院上海生命科学研究院生物化学与细胞生物学研究所的胡红雨(Hong-Yu Hu)研究员,其主要研究方向为蛋白质错误折叠和降解作用。
NEDD8是一种泛素(Ub)样蛋白,其与泛素具有大约60%的一致性及80%的同源性。与泛素相似,成熟的NEDD8可通过称之为NEDD化修饰(neddylation)的类泛素化修饰过程,特异性地与底物蛋白相结合。
cullin家族蛋白是最明确确定特征的NEDD8靶标。CRLs构成最大的E3泛素连接酶亚家族,而Cullins是组成CRLs的骨架蛋白。 cullins 的NEDD化修饰会通过引导构象改变并抑制CRLs与抑制子CAND1结合而促进CRLs的活性。通过控制大量关键调控因子的转换(turnover),CRLs在细胞周期进程、细胞信号传导、转录等许多的生物学过程中起重要作用。
与泛素化作用相似,蛋白质的NEDD化修饰也可以通过NEDD8的异肽酶逆转,这一过程称之为去NEDD化修饰(deneddylation)。除了去NEDD化修饰,NEDD8和NEDD化修饰的底物蛋白质水平也可通过一些细胞因子进行负调控。有研究证实,NUB1L和它的剪接异构体NUB1可通过蛋白酶体降解来调节NEDD8蛋白及其NEDD化修饰的水平,但目前对于其潜在分子机制仍不清楚。
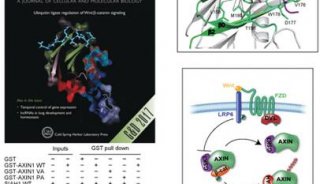
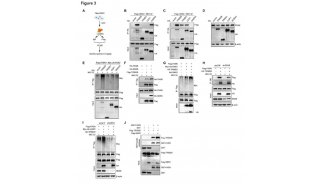
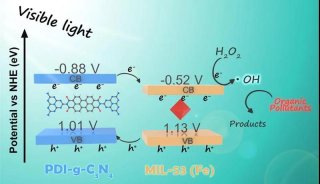
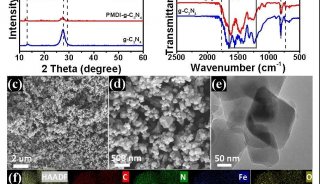
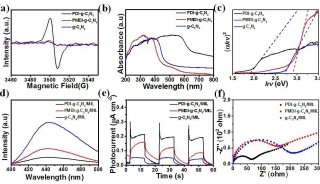
在这篇文章中,研究人员报告称证实NUB1L通过特异性识别NEDD8和P97/VCP,下调了NEDD8的蛋白水平和NEDD化修饰水平。 NUB1L在NEDD8的重要残基Asn51上与NEDD8发生了直接互作,并在P97/VCP的正电荷VCP结合模体上与P97/VCP发生了互作。通过连接P97-UFD1-NPL4复合物(P97UFD1/NPL4机器),NUB1L促进了将NEDD8运送至蛋白酶体进行降解。
-
科技前沿

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件
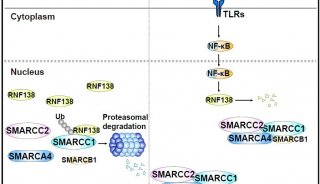
-
焦点事件
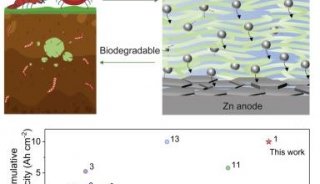
-
焦点事件

-
科技前沿

-
焦点事件

-
科技前沿
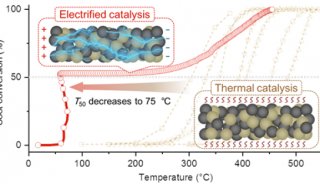
-
综述
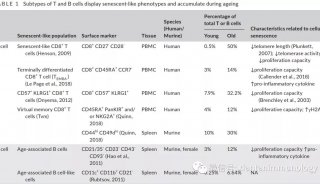
-
科技前沿
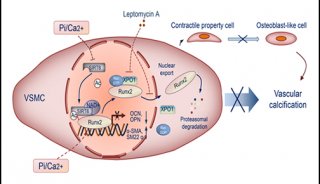
-
科技前沿

-
焦点事件

-
科技前沿
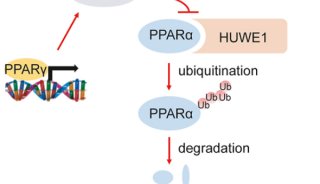
-
政策法规
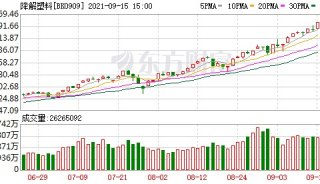
-
科技前沿
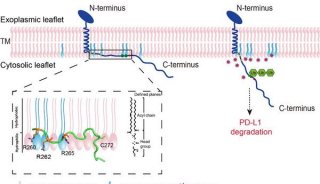
-
科技前沿
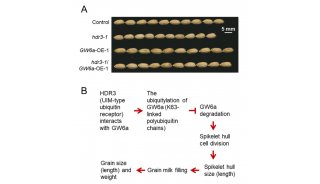
-
科技前沿

-
项目成果
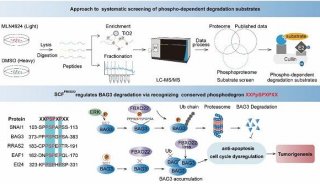
-
科技前沿
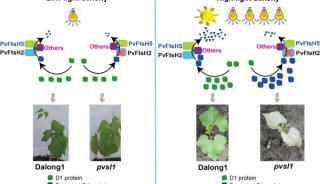
-
技术原理
-
技术原理
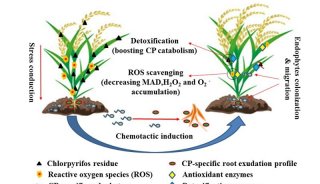
-
项目成果

-
焦点事件

-
项目成果
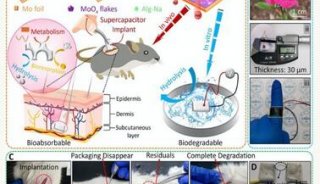
-
焦点事件

-
项目成果
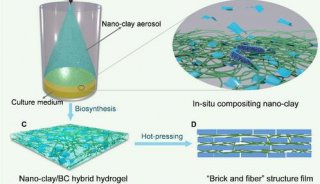
-
焦点事件

-
科技前沿
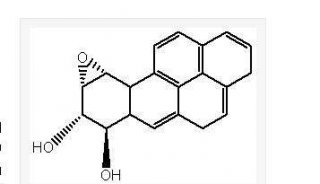
-
项目成果
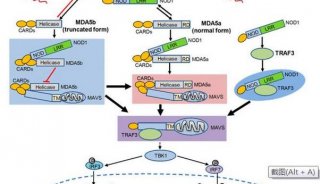
-
项目成果
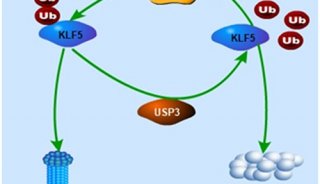
-
项目成果

-
项目成果
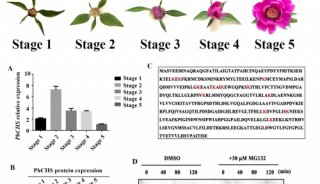
-
科技前沿
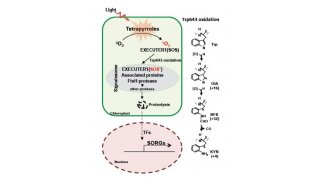
-
科技前沿
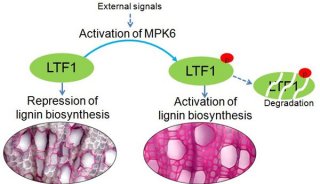
-
项目成果

-
项目成果

-
焦点事件
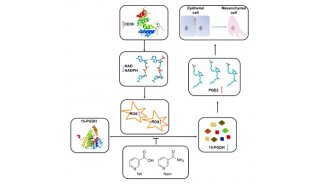
-
焦点事件

-
项目成果