毛细管电泳与MALDI-TOF/MS测定血清转甲状腺素蛋白化学修饰
毛细管电泳与MALDI-TOF/MS联用测定血清转甲状腺素蛋白的化学修饰
引言
转甲状腺素蛋白(transthyretin, TTR)由127个氨基酸组成, 相对分子质量为13 758 000。生理条件下血浆中的TTR与甲状腺素、视黄醇蛋白结合以4聚体形式存在于血液中, 参与甲状腺素的运输[1]。人血清中的TTR 90%以上来源于肝脏细胞合成、分泌, 血清中TTR浓度约为200350 mg/L。血清TTR浓度在感染、营养障碍和肝实质性病变时降低, 可以作为临床的评价指标之一; 其血清浓度降低的幅度与肝实质损害的程度密切相关, 可反映肝合成功能的早期损害。TTR是家族性淀粉样多发淀粉样神经损害(familial amyloidositic polyneuropathy, FAP)和老年性淀粉样变(senile systemic amyloidosis, SSA)患者淀粉样变的前蛋白。
孙续国等建立了基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF/MS)直接测定TTR化学修饰的方法, 并证明血清和脂蛋白内TTR的化学修饰存在明显差异。最近Ueda等 报道了表面增强激光解吸电离飞彩时间质谱(SELDI-TOF/MS)分析发现FAP患者血清TTR存在化学修饰的差异。随着蛋白代谢组学的研究进展, TTR的化学修饰有可能应用于临床分析, 提示临床检测需要快速、直接测定TTR修饰的方法。
毛细管电泳(capillary electrophoresis, CE)技术具有分离效率高、分析速度快、所需样本适应面宽、试剂和样本消耗量少、分离模式多等特点, 适用于临床医学检验样本的分析。毛细管分离的成分可采用紫外检测器(灵敏度较低)和激光诱导荧光检测器(虽然灵敏度高, 但是只适用于有荧光性物质)检测, 对于微量和复杂物质进行分析时多需要衍生化处理, 操作过程复杂, 容易造成测定结果误差。随着质谱(MS)技术的提高, 灵敏度可以达到痕量水平, 同时能够定性和提供物质结构信息。近年来, CE-MS联用方法受到关注。因此, 我们采用CE法分离血清TTR, 并利用MALDI-TOF/MS测定TTR的化学修饰。
材料和方法
一、样本采集
收集20名健康体检者血清, 男8例, 女12例, 年龄5067岁, 经过检查排除心、肝、肾疾病和代谢性疾病。选择原因不明脑出血、核磁共振影像表现脑叶出血、影像学符合SSA特征的SSA患者20例, 男9例, 女11例, 年龄5576岁。空腹8 h采血4 mL, 2 h内分离血清, 用于测定TTR浓度和化学修饰。
二、血清TTR浓度测定
采用酶联免疫吸附试验(ELISA)测定血清TTR浓度。在96孔平底聚苯乙烯酶标反应板(丹麦NUNC公司生产)中加入抗人血清TTR抗体(丹麦DAKO公司生产)100 μ L /孔, 室温反应12 h。用缓冲液洗涤3次后加入250 μ L封闭液, 作用1 h。洗涤3次, 加入100 μ L血清, 100 μ L 兔抗人TTR抗体反应1 h。再加入100 μ L辣根过氧化物酶(HRP)标记抗体(丹麦DAKO公司生产)反应1 h, 用显色试剂显色10 min, 波长405 nm, BIO RED Model 550酶标仪(日立公司)测定。
三、血清TTR分离
血清TTR分离采用CE法。取血清100 μ L加入30 μ L兔抗人TTR抗体, 涡旋混匀后, 4 ℃反应12 h。电泳工作条件:在电压10 kV条件下进样时间3 s, 分离电压10 kV, 检测波长214 nm。美国Bio-Rad公司 HPE100电泳仪, 未涂层石英毛细管25/33 cm(有效长度/总长度), 内径75 μ m。电泳缓冲液为30 mmol/L磷酸缓冲液(pH值7.4)。
四、血清TTR的化学修饰测定
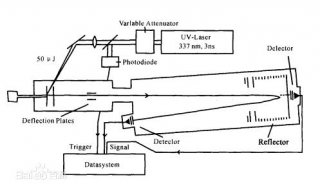
采用MALDI-TOF/MS测定血清TTR的化学修饰。取CE分离TTR复合物, 生理盐水洗涤, 加入醋酸充分混合, 采用Kratos PC Axima CFRplus 质谱仪(日本岛津公司)进行MALDI-TOF/MS分析。选用α -氰基-4-羟基-肉桂酸(α -cyano-4-hydroxy-cinnamic acid, HCCA)为基质液, 脱辅基肌红蛋白[apomyoglobin, 质/荷比(m/z) 16 952.27, Sigma公司]作为相对分子质量标定品。取2 μ L样本上样, 利用仪器进行分析, 获得由不同m/z的蛋白峰构成的质谱图。结果采用日本岛津公司Kratos Analytical Version 2.4 Launchpad软件进行分析。本试验在中科院植物研究所完成。
五、统计学方法
采用SPSS11.0软件进行成组独立样本的t检验, P< 0.05表示差异有统计学意义。所有测量数据用 x−x-± s表示。
结果
一、SSA组和健康对照组血清TTR浓度
SSA组血清TTR浓度为(0.26± 0.03)g/L, 健康对照组为(0.25± 0.04)g/L, 2组间差异无统计学意义(P> 0.05)。
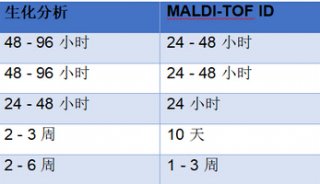
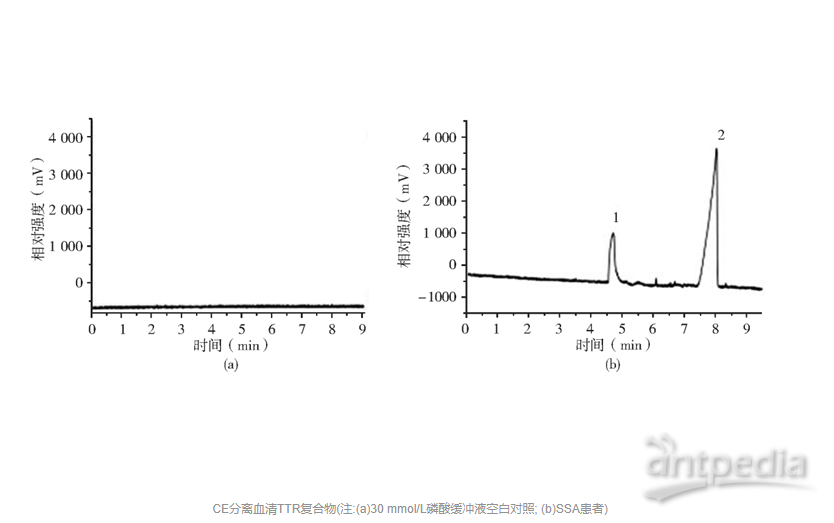
二、CE分离提取血清中TTR复合物
采用CE检测30 mmol/L 磷酸缓冲液(pH值7.4), 吸光度扫描为一水平线, 见图1(a)。健康对照组与SSA组血清加入抗人血清TTR抗体孵育, CE检测均可见2个吸收峰。图1(b)为SSA患者(男, 67岁)血清与抗体孵育后利用CE分离提取。电泳出现2个蛋白吸收峰, 抗体相同, 可能为TTR蛋白修饰基团导致CE出现2个吸收峰。
 |
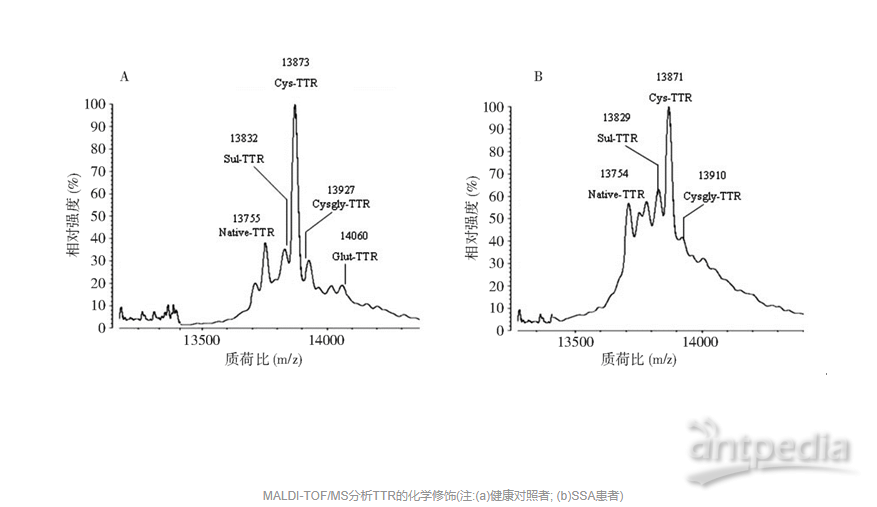
三、 MALDI-TOF-MS分析血清TTR化学修饰
用MALDI-TOF-MS分析CE分离提取的TTR的化学修饰。SSA组血清TTR和健康对照组均发现4种主要类型的TTR修饰峰。通过与标准对照计算相对分子质量, m/z分别为13 750.86± 1.48、13 830.63± 2.76、13 871.70± 2.70、13 919.00± 14.77, 经过与氨基酸相对分子质量比较, 分别对应:未修饰-TTR(Native-TTR)、磺化-TTR(Sul-TTR)、半胱氨酸-TTR(Cys-TTR)和半胱氨酸甘氨酸-TTR(Cysgly-TTR)。见图2。
 |
讨论
TTR基因位于18号染色体长臂18q12.1, 约7 kb, 包含4个外显子和3个内含子, 外显子1编码20个氨基酸的信号肽和蛋白质的前3个氨基酸残基、外显子2编码447位氨基酸残基、外显子3编码4792位氨基酸、外显子4编码剩下的氨基酸残基93127。
淀粉样变性疾患是淀粉样前蛋白形成蛋白纤维沉积于细胞间质导致组织细胞和器官功能损害, 引起一系列临床疾病。TTR是FAP和SSA的淀粉样变前蛋白。对于TTR形成淀粉样变纤维机制研究发现, 在酸性条件下孵育一定时间之后, TTR四聚体开始转变成二聚体, 然后转变成TTR单体, 最后形成淀粉样变纤维。FAP患者淀粉样变前蛋白是突变的TTR, 而SSA患者淀粉样变前蛋白则是野生型的TTR。SSA患者淀粉样变主要沉积于心脏的组织, 主要临床表现为心脏传导阻滞、收缩和舒张功能障碍, 同时累及肠道组织、神经以及腺体等他脏器。SSA患者心脏淀粉样变沉积中, 心肌细胞内未发现TTR mRNA, 提示淀粉样沉积组织实质细胞并非表达淀粉样变前蛋白, 组织内沉积的淀粉样变蛋白为血清TTR沉积于组织内。
最近, 蛋白代谢组学相关技术有了飞速发展。该技术能够测定蛋白质的化学修饰。利用该技术分析健康人群血清TTR蛋白, 发现多种化学修饰, 进一步分析SSA及FAP患者血清TTR蛋白, 与健康人群相似均能够发生化学修饰, 提示机体代谢能够使TTR发生化学修饰。具体观察TTR发生化学修饰的比例和类型, 循环血液中的TTR 85%95%发生化学修饰, 非修饰形式部分占总量的5%15%。
MALDI-TOF/MS分析血清中TTR的化学修饰, 不同检测对象内TTR的浓度与试验成功有直接关系。采用ELISA检测健康对照组和SSA组血清TTR浓度, 发现2组之间未见明显差异, TTR浓度在0.180.32 g/L之间。利用ELISA测定血清TTR浓度, 确定MALDI-TOF/MS的检出范围。免疫吸附后, CE分离TTR复合物发现2个蛋白吸收峰, 提示CE可以分离TTR抗体复合物。利用MALDI-TOF/MS检测TTR的化学修饰, 健康对照组和SSA组血清TTR蛋白均发现有化学修饰峰, 分析蛋白吸收峰主要有4种类型。与标准对照计算, m/z分别为13 750.86± 1.48、13 830.63± 2.76、13 871.70± 2.70、13 919± 14.77, 经过与氨基酸相对分子质量比较, 分别对应Native -TTR、Sul-TTR、Cys-TTR和Cysgly-TTR。
有学者研究体外弱酸性条件下, 半胱氨酰化TTR、谷胱甘酰化TTR等野生型化学修饰形式的TTR比非修饰形式TTR和磺化形式TTR淀粉样变倾向更强, 提示了化学修饰在人类淀粉样沉积症中扮演着重要的角色。Nakanishi等从体外实验证明TTR形成淀粉样变的机制, 比较在弱酸性条件下不同化学修饰TTR(Sul-TTR、半胱氨酰化-TTR、还原性-TTR)形成淀粉样纤维的程度, 提出TTR的磺化可能是TTR相关的淀粉样纤维形成的重要触发步骤。
本研究使用了ELISA、CE和MALDI-TOF/MS 3种方法建立测定血清TTR化学修饰的方法。使用ELISA初步检测TTR浓度, 利用CE分离效果好的优势和MALDI-TOF/MS能分析结构信息的特点使分析方法同时具有高分离效率与高灵敏度, 为今后进一步探索淀粉样变性的发病机制提供了一种简便的检测方法。