投稿被拒,华裔科学家诺贝尔成果被抢发,科研如此艰难
光遗传学(Optogenetics)是近几十年来神经科学领域最大的技术成就,被许多科学家认为是注定会得诺贝尔奖的工作。
2019年9月24日,Ernst Bamberg、Karl Deisseroth、Gero MiesenbÖck,三人因在光遗传学领域的贡献而荣获有诺奖风向标之称的“引文桂冠奖”,再次引发大家对光遗传学是否会获得诺贝尔奖的猜测。
然而,最先开创光遗传学的华裔科学家潘卓华却依然籍籍无名——他没有输在实验室,却输在残酷的科研竞速赛上。
光敏感神经元技术可能会推动医学领域的革命性进展。这项技术名叫“光遗传学”,是近几十年来神经科学领域最大的技术成就。它有望用于治疗失明、帕金森症以及缓解慢性疼痛。此外,它还将广泛用于实验室中研究动物大脑的工作,让科学家们更深入地理解睡眠、成瘾和感知等行为。
因此,斯坦福大学的Karl Deisseroth和麻省理工的Ed Boyden因发明光遗传学技术而成为学界明星,也就不足为奇了。两人近年来拿资助和奖金可谓拿到手软,他们的实验室尽收高端设备和顶尖学生,并且得到了举世的称赞与荣誉,连诺贝尔奖也几乎已成囊中之物。
这个美好的故事却暗藏隐情:也许华裔科学家潘卓华才是开创光遗传学技术的第一人。
然而,甚至连很多神经学家都没有听说过潘卓华这个人。

潘卓华,视觉科学家,就职于美国底特律的韦恩州立大学。他在中国开始了自己的研究生涯,自上世纪80年代赴美攻读博士起就一直旅居美国。他宽阔的鼻梁上戴着金丝边眼镜,脸上常露笑意。在同事眼里,他是一位纯粹的科学家:谦虚、专注且谨慎。
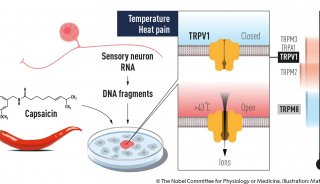
治愈失明的渴望激励着潘卓华的工作。在本世纪初,他就设想出一种让盲人恢复视力的治疗方法——将光敏蛋白导入眼中,通过使其他细胞对光敏感来弥补视杆细胞和视锥细胞的死亡。
向神经细胞中导入把光转换为电信号的蛋白,这就是光遗传学想法的雏形。这样一来科学家就可以通过光远程刺激神经元控制大脑回路。之前有人做过神经元光敏实验,但由于缺少合适的光敏蛋白而功亏一篑。
2003年,随着关于光敏通道蛋白(ChR)研究的发表,该方法有了转机。
ChR是绿藻中发现的一种蛋白质,它通过控制离子进入细胞来回应光信号,从而帮助藻类寻找阳光。
潘卓华说:“那是我生命中最激动人心的事情之一,我当时想,这不就是我们要找的分子,不就是我们要找的光传感器吗!”
他开始尝试着让培养皿内的神经节细胞(我们眼球中直接连接大脑的神经元)表达ChR,直到2004年2月,这些细胞终于表现出光响应的电活性。潘卓华欣喜若狂,他向美国国立卫生研究院(NIH)申请了一笔资助。NIH 拨给他30万美元经费,并称其工作是“一项相当超前、高度创新、探索未知领域的研究”。

含有 ChR 的盲鼠视网膜侧视图。底部的圆形结构是神经元的细胞体。ZHUO-HUA PAN

鼠视网膜的特写,展现带有 ChR 和绿色荧光蛋白的神经元。ZHUO-HUA PAN
然而彼时的潘卓华还没有意识到自己已进入一场分秒必争的竞速赛中,世界各地的研究团队都在试图将 ChR 导入神经元。
Deisseroth和 Boyden都在斯坦福大学,Deisseroth 正在做博后而 Boyden 还在读研。此外至少还有两批人马参与了这场争分夺秒的比赛,分别是美国凯斯西储大学的 Stefan Herlitze 与 Lynn Landmesser 团队以及日本东北大学的 Hiromu Yawo 团队。
当然,尝试用光控制神经元的科学家可不只他们几个。2004年,Gero Miesenbock 和Richard Kramer 已经发表了用其他更复杂的分子实现这一目的的论文。不过ChR才是为这个领域带来革命性变化的工具。
斯坦福的团队早就动过用光控制神经元的念头。他们也注意到了那篇发现ChR的论文。2004年3月,Deisseroth联系到该论文的作者Georg Nagel (在潘卓华首次成功将ChR导入神经元的一个月之后),并从后者处拿到 ChR 的 DNA。同年8月,Boyden 对培养皿中的脑神经元进行光刺激,并且记录下了ChR反馈的电活动。
早在六个月前,潘卓华就已经用视网膜神经元进行了同样的实验,但他的工作被抢发了。
Boyden 现已是 MIT 的教授,STAT 告知他潘卓华率先完成这项实验时,他颇感惊讶。
“挺有意思哈。我还不知道有这么回事。” Boyden 说。
Boyden 表示,科学家们进行各自的研究,有时会采取合作的方式,有时则分头开展,发生你追我赶互相争抢的情况。“有新发现的时候学界怎么评判功绩?这个问题还蛮有趣的。总会有有意或无意的协作存在。”
斯坦福新闻办公室称 Deisseroth 无暇接受采访。对于 STAT 提出的问题,发言人Bruce Goldman表示,潘卓华的研究与光遗传学的应用还相差甚远,而 Deisseroth 博士2005年发表的那篇被广泛引用的论文才打开精细神经科学的新世界大门。
潘卓华说,数年前他或许曾向 Boyden 提及过自己实验的时机掌控,但他也表示:“我不想就此问题谈论太多,免得让人不舒服。”
这种态度符合潘卓华一贯的作风——勤奋、内敛、不愿成为焦点。韦恩州立大学是一所小型大学,在科研界名声不显。潘卓华在一所州立学校攻读博士,然后数十年从事着默默无闻的研究。也许正是这些因素导致了接下来发生的事:他想要向世人宣告自己的重大进展时,却没能得到应有的关注。

潘卓华实验室里的人眼模型。SEAN PROCTOR FOR STAT
2004年夏天,潘卓华一直在探索将 ChR 蛋白在导入活体眼球的方法。最后他选择用病毒感染眼球的细胞,以此导入ChR 的 DNA。他在萨鲁斯大学的同事 Alexander Dizhoor 教授改造了 ChR 的 DNA,引入绿色荧光蛋白示踪。
2004年7月,潘卓华用病毒感染了第一只老鼠,大约五周之后观察其视网膜,呈现在他眼前的是一片绿色的海洋——视网膜上成千上万的神经节细胞都拥有带绿色荧光的 ChR。他向这些细胞中植入监测电极,然后进行光照,细胞反馈了一阵电活动—— ChR 起作用了。虽然这只是第一步,但却是革命性的一大步,它预示着潘卓华的方法也许能让盲人重见光明。
潘卓华说:“真是天公作美。”
根据潘卓华向 STAT 展示的投稿信,他与Dizhoor就这项工作写了一篇论文并于2004年11月25日投到了Nature。后来根据Nature 编辑的建议,他们改投到专业性更强的期刊Nature Neuroscience上,却遭到拒稿。次年年初,潘卓华又将论文投到Journal of Neuroscience,经评审后再次被拒。
心灰意冷的潘卓华开始对论文进行修改,并于2005年5月来到佛罗里达州的罗德岱堡参加视觉和眼科学研究协会(Association for Research in Vision and Opthamology)的会议。
会上他介绍了自己在神经元中使用 ChR 的工作。这场报告只用了15分钟,却可能是其发明时间表中最明确的声明。
这次声明意义重大,因为几个月后,也就是2005年8月,Nature Neuroscience 刊载了一篇关于用 ChR 让神经元对光敏感的论文。
这篇论文的作者正是Edward Boyden 和 Karl Deisseroth,值得一提的是,此后因CRISPR基因编辑而大名鼎鼎的张锋也是这篇论文的作者之一,此时的张锋正在 Karl Deisseroth 实验室读博。

潘卓华从发给他论文的同事那里得知了这个消息。“糟糕,糟糕透了。”潘卓华顿了顿说:“我们实在不太走运。”
Deisseroth和Boyden 的论文与潘卓华的论文有些许不同。他们简单地证明了可以用 ChR 控制培养皿中神经元的活动;而潘卓华则等到活体动物实验成功后才发表。
而且Deisseroth和Boyden 展示了极其精确的时间控制,开灯时间仅为1毫秒。但他们的成就大体相同:利用 ChR 成功地让培养皿中的神经元响应光照。
斯坦福团队的论文一段时间后才开始变热,不过的确成了大热之作。这项工作让 Deisseroth 和 Boyden 的科研生涯一飞冲天,两人的团队得到了大笔的科研经费(Deisseroth 在斯坦福,Boyden 在 MIT),也因此招到了许多天资聪颖的学生。2007年,纽约时报开始报道Deisseroth 在光遗传学领域的突破性进展,这篇论文的引用量也开始爆炸式增长。

MIT 媒体实验室的 Ed Boyden。KEITH BEDFORD/THE BOSTON GLOBE
直到2006年4月,潘卓华终于在Neuron上发表了自己的论文,却遭受冷遇。加州大学伯克利分校同样研究视觉的神经科学家Richard Kramer回忆道:“这项工作没什么创新性,给人的感觉就是‘看吧,既然可以把 ChR 导入大脑神经元,当然也可以导入视网膜的神经元。’这很了不起吗?并不。”
短短几个月之差,一切都不同了。
为什么潘卓华的论文没能最先发表呢?他或许永远也不会知道答案。在 Boyden 的论文出来之后,潘卓华写信给 Nature Neuroscience 质疑为什么自己的论文遭拒,Boyden 的却发表了。
编辑回复说,两篇论文有相似之处,Boyden 等人是将成果作为一项新技术而非科学发现提出的。潘卓华的论文看上去过于狭隘,仅仅关注用 ChR 恢复视觉,而Boyden的文章则眼界开阔,他提出 ChR 是能够在神经科学领域广泛运用的工具。
其他研究者向 Journal of Neuroscience 递交的审稿意见,为了解人们如何看待潘卓华的论文提供了更多的线索。有一位审稿人很欣赏这篇论文,只提出了少量修改意见。另一位则写了一大段话表示这项研究“野心太大”、“非常初级”并总结道:“没有什么能吸引大多数神经科学家的亮点”。
事后,潘卓华论文的共同作者Dizhoor看到这条评论不禁呵呵。2006年,审稿人最终允许潘卓华论文的扩充版小修后发表。
但这并没有让潘卓华晋升为光遗传学大牛。在这场论文发表的盛宴中,他姗姗来迟,之前已经有三个团队发表了关于ChR的工作。他没能分享到Deisseroth与Boyden近来收获的两项大奖,即2013年的The Brain Prize(光遗传学的6位发明者共享100万欧元)与2015年的 科学突破奖(Boyden和Deisseroth 每人300万美元)。
自2005年起,Deisseroth 已经凭借光遗传学方面的工作从NIH拿到了超过1800万美元的资助,而Boyden得到的资助超过1000万美元。他们还通过其他项目为自己的实验室带来额外的基金资助。Boyden是一位高产的演讲者,多次登台TED;Deisseroth则在2015年接受了The New Yorker杂志的深度采访。

Karl Deisseroth 获得2016年生命科学突破奖
相比之下,潘卓华过去十年间总共也只得到大约300万美元和一项NIH的资助,堪堪能让研究项目继续下去。相关的大多数荣誉只是来自韦恩州立大学。根据其个人主页的介绍,他被邀请做过几次报告,最近一次是俄罗斯的一个技术展。

潘卓华在韦恩州立大学的实验室中,这里是他一直研究 ChR 的地方
这个故事引出了一个问题:在科研领域,究竟怎样才算发明。近年来,随着研究日益全球化、生物技术与医学发现的奖项日益丰厚,这个问题一直困扰着科学家们——包括旷日持久的CRISPRZL之争。
至于答案,需要具体问题具体分析。
学术界一般认为第一个发表相关论文的科学家即为技术的发现者或发明者。但这个标准也可能出现问题,潘卓华的遭遇就是极好的例证。
发表在eLife的一篇文章中,生物学家Ronald Vale和Anthony Hyman指出“论文投递和发表之间的间隔可能长达几周,有些甚至超过两年。期刊延缓了知识从一位科学家向整个科学界的传播的过程,也会产生不公。”
而且,审稿人可能会对熟悉的作者或知名机构有一定偏向性。隐去作者姓名的盲审可以弱化这种影响,不过也有不少科学家对此存疑,因为研究成果往往在之前的一些会议上就讨论过了。
Vale和Hyman主张科学家们在向期刊投稿之前,将论文公布到bioRxiv之类的“预印本网站”上。如果这样的网站在2004年就得到广泛应用,潘卓华就可以在那上面公布自己被拒稿的成果,声明自己对技术的发明权。
然而,那是否意味着他将出现在诺贝尔奖得主的名单上呢,这也很难说。Kramer 认为,即便潘卓华将论文发表在bioRxiv上,他大概仍旧会被诺奖拒之门外,因为这样的发表没有经过同行评审。而这一点恰恰是光遗传学发明者能否夺得诺奖的关键。法律体系的运行并不完全遵照学术界的规则。一位美国律师协会ZL法方向的专家表示,在本世纪之初,为了证明ZL的优先权,一般你得说明什么时候你真正设想出了该发明——即脑中的灵光一闪,“啊哈,有了!”以及什么时候将发明付诸实践——即真正完成并证实了自己的设想。
基于这些标准,新发现诞生于在实验室中被证实的那一刻,这个时间点甚至比向预印本网站投稿还要早。
接下来是公众的评判。科学家们逐渐成为公众人物,开始玩Twitter、上深夜脱口秀节目。
哈佛医学院的教授Richard Masland 拥有失明基因疗法的多项ZL,他说:“与之前相比,现在科研质量的评判受到非科学因素的影响更大。”
也许身处韦恩州立大学使得潘卓华并没有发表大热论文所需的资源。从事高水平研究是存在实际成本的。还有,顶级大学的资深研究者往往会指导年轻教授,阅读他们的工作并帮助他们提高水平。
潘卓华认为,这种现状会让他在与知名研究机构(如麻省理工或斯坦福)的科学家的竞争中处于劣势。不过他也说:“当然,我并没有确凿证据。”为人低调、英语又非母语的潘卓华很难像Boyden 和Deisseroth 那样提高自己的知名度。
加州大学伯克利分校的视觉研究者Kramer说:“他很少像这个领域的其他人那样演讲、上节目。然而走出实验室、自我推销恰恰是科研竞赛中的一个重要环节。”ChR研究先驱之一的凯斯西储大学教授Landmesser 说:“我认为存在这样一种倾向,谁先走出去,谁就能得到更多关注。”
也许,拍一段大学宣传短片就能引发全国性的新闻,大家在提名大奖候选人、拍电视节目时就会先想到你,不知何时你就被冠以“发明者”的头衔,谷歌搜索“谁发明了光遗传学技术?”也会自动弹出你的名字。


潘卓华实验室中的一块黑板和玻璃器材干燥架。他已经利用ChR帮助盲鼠复明。SEAN PROCTOR FOR STAT
最终,潘卓华和Boyden、Deisseroth 的团队的成果都拿到了ZL。
潘卓华2005年5月的讲座一度威胁到 Boyden 与 Deisseroth 的ZL——由于潘卓华的摘要比他们早了一年多发表,美国ZL局多次拒绝了他们的申请。
最后,Deisseroth和Boyden 签署了一份文件,声明他们在潘卓华的会议摘要发表之前就已经发明了在实验室中使用ChR的方法。相关的ZL到2016年3月才获批,距离当初提交申请已将近十年。
现在,Deisseroth是Circuit Therapeutics 公司的联合创始人兼科学顾问。这家公司主要研究基于光遗传学的疗法,其技术应该正是来源于Deisseroth申请的ZL。(Circuit Therapeutics 公司拒绝就其知识产权许可的详情发表评论)。
潘卓华也拿到了一项用ChR恢复眼球视力的ZL。他的ZL得到了RetroSense的许可,还获得了2015年天使投资协会(Angel Capital Association)的奖项。Retrosense今年启动了用基因疗法将藻蛋白导入盲人眼球的临床实验,其CEO还顺便向STAT提到了潘卓华在光遗传学技术发明过程中起到的作用。这是光遗传学技术在人类身上的第一次应用,也是非人类基因首次用于基因疗法。
现在,德克萨斯州已在进行向盲人眼中植入藻类DNA和蛋白质的实验。这正是潘卓华一直所致力的目标。“有一件事让我倍感欣慰,那就是即便到了现在,我们的临床实验仍然一马当先。”
但是目前美国尚未批准基因疗法用于临床使用,光遗传学技术在人类身上的应用还有很长的路要走。加州大学伯克利分校的神经科学家丹阳坦言,该技术短时间内还不会用于临床治疗。“我认为这项技术的安全性审核还要花很长很长的时间。”
至于发明本身,一些科学家认为潘卓华尚不具备Deisseroth 和Boyden所拥有的获得大奖的资格。Stefan Herlitze 也是ChR 用于神经元的工作被抢发的研究者之一,他说:“我不得不承认,Deisseroth 与 Boyden 的确推动了这个领域的发展。”
Boyden认可这一说法。“Deisseroth和我热衷于如何控制大脑中的细胞类型这一大课题, ”他说,“近年来,我们将这些分子的应用推向了极致。”
因此,或许谁发明了光遗传学并不重要,重要的是谁将科学的边界延伸到更远的地方。
当被问及自己是否也配得上Boyden与Deisseroth 所拥有的那份荣誉时,潘卓华没有回答。随后他告诉STAT,“毫无疑问,Deisseroth 同样做出了非常漂亮的工作。但他也十分幸运,因为如果我们的工作在他之前发表,故事将被改写。我们将得到更多荣誉。”
这就是潘卓华要讲的全部故事。如今他还在底特律继续研究用于治疗失明的改良版ChR。“我的实验室规模非常小,主要还是关注恢复视力的问题。”潘卓华说到。
-
精英视角

-
焦点事件

-
企业风采

-
企业风采

-
投融资

-
企业风采

-
企业风采

-
精英视角

-
企业风采

-
企业风采

-
科技前沿

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
企业风采
-
企业风采

-
焦点事件

-
精英视角

-
企业风采

-
焦点事件

-
企业风采

-
企业风采

-
焦点事件

-
企业风采

-
企业风采

-
企业风采

-
企业风采

-
招标采购

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
科技前沿

-
会议会展

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
市场商机
-
项目成果

-
企业风采

-
企业风采

-
精英视角

-
技术原理
-
科技前沿

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
精英视角

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角

-
企业风采

-
项目成果
-
精英视角