植物体内可溶性蛋白和非可溶性蛋白含量的测定实验
| 实验方法原理 | 植物材料经Tris-HCl缓冲液研磨、离心后,可溶性蛋白质溶于上清液中,非可溶性蛋白则存在于沉淀部分。将沉淀用碱水解,则会得到非可溶性蛋白的提取液。蛋白质提取液与考马斯亮蓝G-250反应呈蓝色。在一定范围内,蛋白质的含量与反应液在595nm波长的吸光度呈正比,由此可求出蛋白质的含量。 |
|---|---|
| 实验材料 | |
| 试剂、试剂盒 | |
| 仪器、耗材 | |
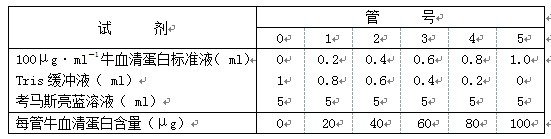
| 实验步骤 | 1. 牛血清蛋白标准曲线的制作 |
推荐
-
仪器推荐
-
仪器推荐

-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 5034
询底价 Tel:400-6699-117 转 5034 -
仪器推荐
-
焦点事件