连发4篇顶刊——颜宁团队系统介绍钙离子通道蛋白调控机制
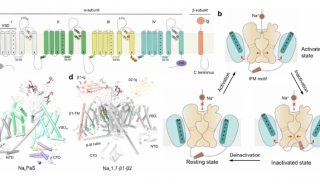
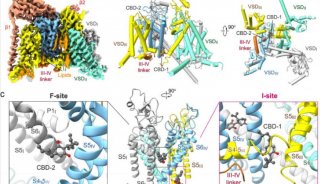
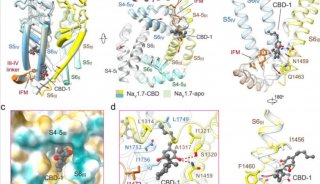
作为从心肌的肌浆网(内质网)释放Ca2 +的开关,2型ryanodine受体(RyR2)受到多种调节剂的复杂调节。RyR2介导的Ca2 +释放失调与威胁生命的心律不齐有关。关键调节剂,例如Ca2 +,FKBP12.6,ATP和咖啡因对RyR2的调节机制仍不清楚。
2019年12月2日,颜宁团队在PNAS 在线发表题为“Molecular basis for allosteric regulation of the type 2 ryanodine receptor channel gating by key modulators”的研究论文,该研究报告了猪RyR2的4种冷冻电子显微镜(cryo-EM)结构,这些结构与不同的调节剂结合在一起,再加上之前发表的结构,提供了对RyR2调控的机械观察。
单独的Ca2 +引起中央结构域的收缩,这有利于S6束的扩张,但不足以打开孔。 小分子激动剂PCB95帮助Ca2 +克服了打开的障碍。FKBP12.6引起中央结构域的松弛,从而使中央结构域与S6束分离,即使存在Ca2 +和PCB95的情况下,RyR2也可以在封闭状态下稳定。尽管当用咖啡因和5'-三磷酸腺苷(ATP)代替PCB95时通道是开放的,但单独的调节剂都不能充分对抗拮抗作用以打开通道。这项研究为这些调节剂对RyR2通道门控的远距离变构调节提供了重要的见识,并为重要机制的机理提供了重要的框架,以了解这一关键参与者在心肌的兴奋-收缩耦合中的调节作用。
另外,2019年11月25日,颜宁团队在Nature在线发表题为“Cryo-EM structures of apo and antagonist-bound human Cav3.1”的研究论文,该研究报告了单独的人类Cav3.1的冷冻电镜结构以及与高度Cav3选择性阻滞剂Z944结合的冷冻EM结构,其分辨率分别为3.3Å和3.1Å。弓形的Z944分子在孔结构域的中心腔中倾斜,宽端插入重复序列II和III之间的界面的窗孔中,窄端像塞子一样悬在细胞内门上方。这些结构为比较研究不同Cav亚家族之间不同的通道特性提供了框架。这是西湖大学首次以第一单位在其发表成果。
2019年7月5日,原清华大学颜宁(清华大学第一单位)等人Nature 在线发表题为“Modulation of cardiac ryanodine receptor 2 by calmodulin”的研究论文,该研究报道了RyR2的8个冷冻电子显微镜(cryo-EM)结构,它们共同揭示了不同形式CaM的分子识别特征,并提供了对CaM对RyR2通道门控的调节的见解。Apo-CaM和Ca2 + -CaM结合由手柄,螺旋和中心区域形成的细长裂缝中的不同但重叠的位点。RyR2上CaM结合位点的转变受Ca2 +与CaM结合而不是RyR2的控制。Ca2 + -CaM诱导各个中心结构域的旋转和域内移位,导致PCB95和Ca2 +激活的通道的孔闭合。相比之下,ATP,咖啡因和Ca2 +激活通道的孔在Ca2 + -CaM存在下保持开放,这表明Ca2 + -CaM是RyR2门控的许多竞争调节剂之一;
2019年5月30日,颜宁(清华大学为第一通讯单位)及吴建平共同通讯在Cell 在线发表题为“Molecular Basis for Ligand Modulation of a Mammalian Voltage-Gated Ca2+ Channel”的研究论文,该研究报告了Cav1.1与拮抗药物硝苯地平,地尔硫卓和维拉帕米的复合物的冷冻电子显微镜(cryo-EM)结构,分辨率分别为2.9Å,3.0Å和2.7Å;Cav1.1与DHP激动剂Bay K 8644复合物的冷冻电子显微镜(cryo-EM)结构,分辨率为2.8Å。地尔硫卓和维拉帕米穿过孔域的中心腔,直接阻断离子渗透。尽管硝苯地平和Bay K 8644在重复III和IV的界面处占据相同的位点,但协调细节支持以前的功能观察。这些结构阐明了不同Cav配体的作用模式,并为结构引导的药物发现建立了框架。总之,结构研究阐明了三种临床应用的拮抗剂和原型激动剂在原子水平上识别和调节L型Cav通道的分子基础,并为大量实验和临床数据提供结构解释。这些结构为未来针对Cav通道病的药物发现奠定了基础;

2型ryanodine受体(RyR2)是在心肌细胞的肌质网(SR)膜中表达的钙(Ca2 +)通道,负责在兴奋-收缩偶联(ECC)过程中将Ca2 +从肌质网(SR)释放到细胞质中。从生理学上讲,该通道的开放是响应于Ca2 +进入由L型电压门控Ca2 +通道(Cav1.2)介导的细胞而发生的,该过程通常称为钙诱导的钙释放(CICR)。RyR2介导的Ca2 +释放是许多生物学过程的基础,从肌肉收缩到学习和记忆。RyR2功能异常与多种严重疾病的病理学有关:RyR2的150多个突变可能与儿茶酚胺能性多形性室性心动过速1型,致心律失常性右室发育异常2型和特发性心室纤维性颤动有关。
由于RyR2对于每个心跳都很重要,因此它会受到大量调节剂(包括离子,特别是Ca2 +和Mg2 +)的复杂调节;小分子,例如5'-三磷酸腺苷(ATP)和咖啡因;蛋白质,例如FK506结合蛋白12和12.6(FKBP12 / 12.6)和钙调蛋白(CaM)。在ECC期间,RyR2通过CICR机制激活,而骨骼肌特异性亚型RyR1通过与Cav1.1机械偶联而激活。尽管RyR1和RyR2都显示出对细胞质Ca2 +浓度的双相依赖性(即,被微摩尔水平的Ca2 +激活并被毫摩尔水平的Ca2 +抑制),但RyR2被细胞质Ca2 +激活的程度更大,需要更高的[Ca2 +]进行抑制,表明这2个RyR同工型之间的重要区别在于它们对Ca2 +的激活和抑制。
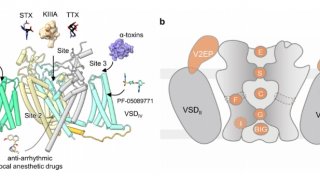
FKBP12.6是最突出的RyR2结合蛋白之一。尽管已经广泛研究了FKBP12.6对RyR2的作用,但FKBP12.6在调节通道中的确切作用仍存在争议。有报道指出,FKB12.6将RyR2稳定在封闭状态,以防止SR Ca2 +泄漏到细胞质中,而FKBP12.6与RyR2的解离导致SR Ca2 +泄漏,最终损害了收缩力并促进了心律不齐。但是,其他研究小组也报告了相互矛盾的发现,这引发了一个问题,即FKBP12.6是否在心力衰竭中发挥病理生理作用。一项研究表明,FKBP12.6和FKBP12均不影响RyR2功能;另一项研究表明,FKBP12可以激活RyR2,而FKBP12.6可以作为FKBP12的拮抗剂而不会直接降低RyR2的开放概率。因此,FKBP12.6在RyR2调节中的病理生理作用需要进一步研究。
单通道研究报告说,单独的胞质Ca2 +是RyRs的弱激活剂,在没有其他激活配体的情况下,Po不会增加到0.5以上。微摩尔胞质Ca2 +加上第二个配体的存在是通道完全活化所必需的。ATP是一种众所周知的生理激动剂,可能与RyR2组成性结合,因为心脏细胞中的细胞ATP浓度处于毫摩尔水平。咖啡因长期以来一直用作研究RyR介导的Ca2 +释放和心律失常的药理探针,而2,2',3,5',6-五氯联苯(PCB95)也激活RyRs。
在没有FKBP12.6的PCB95 / Ca2 +(表示为P / Ca2 +)和在具有FKBP12.6的ATP /咖啡因/ Ca2 +(表示为F)下已捕获处于开放状态的RyR2的结构。但是,每个单独的调节剂对RyR2门控的调节需要通过比较结构研究进一步剖析。
为了解决这些问题,研究人员特此报告猪RyR2与不同的调节剂结合的4种冷冻电子显微镜(cryo-EM)结构,这些结构与先前已发表的结构一起,为这些关键调节剂对RyR2通道门控的长程变构调节提供了重要的见识。
具体而言,单独的Ca2 +引起中央结构域的收缩,这有利于S6束的扩张,但不足以打开孔。 小分子激动剂PCB95帮助Ca2 +克服了打开的障碍。FKBP12.6引起中央结构域的松弛,从而使中央结构域与S6束分离,即使存在Ca2 +和PCB95的情况下,RyR2也可以在封闭状态下稳定。 尽管当用咖啡因和5'-三磷酸腺苷(ATP)代替PCB95时通道是开放的,但单独的调节剂都不能充分对抗拮抗作用以打开通道。这项研究为这些调节剂对RyR2通道门控的远距离变构调节提供了重要的见识,并为重要机制的机理提供了重要的框架,以了解这一关键参与者在心肌的兴奋-收缩耦合中的调节作用。