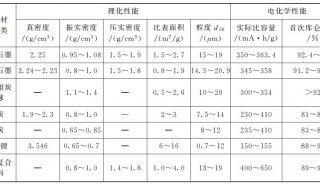
离子的特征
离子是组成离子型化合物的 基本粒子。离子型化合物在任何状态下(晶体、 熔融状态、蒸气状态或溶液中)都是以离子的形式存在的。因此,离子的性质在很大程度上决定着离子化合物的性质。就是说,离子的性质,即离子的三种重要特征:离子的电荷、离子的半径、离子的电子层结构的类型(简称离子的 电子构型)是决定离子型化合物的共性和特性的根本原因。
(1)离子的电荷
离子 电荷对于离子的性质以及所组成的离子型 化合物的性质,都有很大影响。即使是同一种元素,当形成不同电荷的离子时,由它们所组成的离子型化合物的性质也会有较大的差异。例如,铁元素能形成Fe 2+、Fe 3+两种离子,这两种离子及其化合物在性质上就大不相同。Fe 3+比Fe 2+的正电荷多,在一定条件下,Fe 3+能夺取1个电子变成Fe 2+,而相反,Fe 2+则有失去1个电子变为Fe 3+的倾向。Fe 3+在溶液中能跟SCN -离子作用生成血红色的Fe(SCN) 2+离子,而Fe 2+则不发生这种反应;Fe 3+在 水溶液里呈黄色,Fe 2+在水溶液里却呈浅绿色等。
(2)离子的电子构型
离子的电子层结构类型不同,对离子化合物的性质亦有一定的影响,例如,Na和Cu离子的电荷数相同,都是+1价的离子,它们的离子半径也很相近,Na的半径是0.095 nm,Cu的半径是0.096 nm,但它们相应的化合物的性质却有较大的差别:如 NaI易溶于水,而CuI不易溶于水。这主要是由于Na的 电子构型(2s 2p)和Cu的电子构型(3s 3p 3d)很不相同。
(3)离子的半径
原子或离子的绝对大小是无法确定的,因为原子核外电子并非在固定的轨道上运动。而通常说的 离子半径是指离子的有效半径,它是通过各种结构分析实验测定两个异号离子A和B所组成的离子型化合物的核间距d求算出来的。而d等于A的半径r 1与B的半径r 2之和,即
d=r 1+r 2
由此可见,离子半径只能近似地反映离子的大小,离子半径随配位数、离子的价数等等而改变。
离子半径求算时,必须假设某个离子的r1为已知,然后依据r 2=d-r 1公式求出r 2。1926年,戈尔德施米特由晶体结构数据确定了氟离子和氧离子的半径分别是0.133 nm和0.132 nm,然后以此为基准,一一推算出其他各离子的半径。
定义一:描述离子大小的参数。取决于 离子 所带 电荷、 电子分布 和晶体结构型式
离子半径
电荷、 电子分布和 晶体结构型式。设r阳为阳 离子半径,r阴为阴离子半径。r阳+r阴= 键长。r阳/r阴与晶体类型有关。可从 键长计算离子半径。一般采用Goldschmidt半径和Pauling半径,皆是NaCl型结构 配位数为6的数据。Shannon考虑了配位数和 电子自旋状态的影响,得到两套最新数据,其中一套数据,参考电子云密度图,阳离子半径比传统数据大14pm,阴离子小14pm,更接近晶体实际。 定义二:反映离子大小的一个 物理量。离子可近似视为球体, 离子半径的导出以正、 负离子半径之和等于 离子键 键长这一 原理为基础,从大量X射线 晶体结构分析实测键长值中推引出离子半径。 离子半径的大小主要取决于离子所带电荷和离子本身的 电子分布,但还要受离子化合物结构型式(如 配位数等)的影响,离子半径一般以配位数为6的氯化钠型晶体为基准,配位数为8时,半径值约增加3% ;配位数为4时,半径值下降约5%。负离子半径一般较大,约为1.3~2.5埃;正离子半径较小,约为0.1~1.7埃。根据正、负离子半径值可导出正、 负离子的半径和及 半径比,这是阐明 离子化合物 性能和 结构型式的两项重要因素。