揭示脑损伤微环境塑造巨噬细胞促进修复的新机制
Sci Adv | 王红艳/胡锦/魏滨合作揭示脑损伤微环境塑造巨噬细胞促进修复的新机制
颅脑创伤(traumatic brain injury,
TBI)是45岁以下人群致死和致残的主要原因,其中免疫反应在损伤修复的病理过程中发挥关键作用。早在1979年Czlonkowska等(J Neurol Sci, 1979,43(3):455)报道:脑卒中后存在细胞介导的免疫功能受损,但具体机制并不清楚。之后,Meisel等(Nat Rev Neurosci, 2005,6(10):775)提出了中枢神经系统损伤诱导的免疫抑制综合征(CNS injury-induced immunodepression syndrome, CIDS)的概念。这种免疫抑制状态可能让TBI病人更容易发生各种感染,但是否及如何有助于脑损伤修复的研究仍不清楚。鉴于目前脑外伤治疗的临床试验都未获得满意结果,探究TBI患者免疫状态和机制将有望提出治疗TBI的新策略。
3月12日,Science Advances在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王红艳研究员团队与复旦大学附属华山医院神经外科胡锦教授团队及上海大学魏滨教授团队合作的研究成果:M-CSF, IL-6 and TGF -promotes generation of a new subset of tissue repair macrophage for traumatic brain injury recovery,揭示了脑损伤微环境塑造巨噬细胞促进修复的新机制,
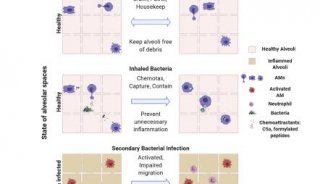
为了探索脑外伤后免疫状态的变化,作者检测了TBI病人外周血和脑脊液样本,构建脑外伤小鼠模型,发现相比其他免疫细胞,单核/巨噬细胞显著增多;并且M-CSF, IL-6 and TGF-1(简称M6T)的表达显著升高,与TBI患者预后相关。作者进一步利用CD45.1/45.2的骨髓移植模型,利用红色荧光tdTomato+转基因小鼠骨髓移植模型,或者利用透明斑马鱼脑损伤的模型,均证实脑外伤的微环境高表达M6T,能诱导生成更多单核/巨噬细胞,并促进外周的巨噬细胞聚集到脑损伤部位。将损伤部位的促炎巨噬细胞、抑炎巨噬细胞、小胶质细胞、内皮细胞分离,经RT-PCR实验发现抑炎巨噬细胞和小胶质细胞是产生M6T的主要来源细胞。
在体外实验,M6T刺激的小鼠骨髓更早分化成巨噬细胞细胞,并且比单一细胞因子或IL4/IL13联合诱导的M2型巨噬细胞表达更高的Arg1,Ym1和Fizz1分子标志物。有意思的是,RNA-seq数据提示经M6T联合刺激的巨噬细胞被诱导性表达一部分小胶质细胞的特异性基因。
在体内对比TBI小鼠和给予外源性M6T预处理的TBI小鼠,发现M6T能促进小鼠脑损伤修复,并且脑损伤部位浸润更多数量的抑炎型巨噬细胞。通过测序和GO pathway富集分析,发现M6T预处理的TBI小鼠损伤部位的巨噬细胞,高表达与TBI小鼠损伤部位的小胶质细胞类似的基因,而且这些基因与神经保护功能、血管生成、细胞迁移功能相关。更重要的是,在移植红色荧光tdTomato+转基因小鼠骨髓后构建TBI的小鼠,骨髓来源的红色巨噬细胞大量浸润到脑损伤部位,其中有一些浸润的巨噬细胞形态的确类似小胶质细胞。
综上图所示:脑损伤微环境高表达的M6T促进外周产生单核/巨噬细胞,并吸引巨噬细胞迁移到脑损伤部位。这群巨噬细胞高表达抑炎巨噬细胞的标志性基因;有一部分被塑造成类似小胶质细胞;并且高表达M6T,形成正反馈环路塑造微环境和组织修复巨噬细胞,最终有利于脑损伤修复。这一发现为免疫治疗脑外伤提供了新的思路。
胡锦教授团队李智奇博士和王红艳实验室肖俊博士后、徐晓燕博士和李伟芸博士是本文的共同第一作者。感谢中科院分子细胞卓越中心景乃禾研究员和周斌研究员、中科院神经所周佳伟研究员的合作,感谢胡苹研究员提供tdTomato+转基因小鼠模型(2015年王红艳与胡苹团队合作发现T细胞分泌三种细胞因子促进肌肉损伤修复,Cell Res)。
-
焦点事件
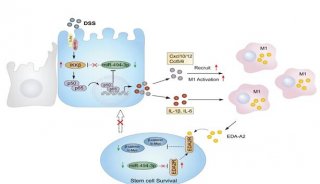
-
项目成果
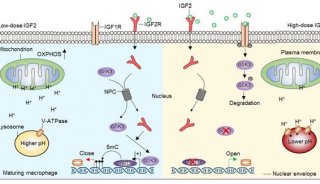
-
项目成果