Horizon公司IGF-1R靶向单抗teprotumumab获美国FDA批准!

Horizon Pharma是一家专注于开发和商业化创新药物以满足罕见疾病和风湿性疾病领域治疗需求的制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已批准Tepezza(teprotumumab-trbw),用于治疗甲状腺眼病(TED)。该批准较处方药用户收费法(PDUFA)目标日期2020年3月8日提前了一个多月。
TED是一种严重的、进行性的、威胁视力的罕见自身免疫性疾病,与突眼(眼球膨出)、复视、视力模糊、疼痛、炎症和面部缺陷相关。Tepezza是一种全人单克隆抗体和胰岛素样生长因子-1受体(IGF-1R)靶向制剂,每三周注射一次,共注射8次。
值得一提的是,Tepezza是FDA批准的第一种也是唯一一种治疗TED的药物。之前,FDA已授予teprotumumab治疗活动性TED的优先审查、突破性药物资格、孤儿药资格、快速通道资格。2019年12月,teprotumumab获得了FDA皮肤科和眼科药物咨询委员会(DODAC)的全票(12-0)通过。
Horizon公司董事长、总裁兼首席执行官Timothy Walbert表示:“今天对于TED患者群体来说是个大喜的日子。TED是一种罕见的、威胁视力的疾病,之前没有FDA批准的治疗方案。Tepezza的批准意义重大,将改变TED的治疗模式,为患有这种可怕疾病的患者群体提供新的希望。”
此次批准,基于II期临床研究和确认性III期临床研究OPTIC(NCT03298867)的积极数据。2019年3月公布的III期研究顶线结果显示,研究达到了主要终点,与安慰剂组相比,teprotumumab治疗组患者眼球突出或鼓胀表现出显著改善:teprotumumab治疗组有82.9%的患者达到眼球突出或鼓胀减少2mm或更多的主要终点,而安慰剂组仅为9.5%,数据具有统计学显著差异(p<0.001)。眼球突出(proptosis)是TED患者发病的主要原因。此外,该研究也达到了全部次要终点,包括复视减少、生活质量改善、临床活动评分降低。该研究中,teprotumumab的耐受性良好,大多数不良事件是轻度或中度,在治疗期间或治疗后可以控制和解决。来自II期研究的数据显示,teprotumumab治疗使眼球突出和活动性TED症状(疼痛、肿胀、红肿、炎症)取得临床意义和高度统计学意义的减少。
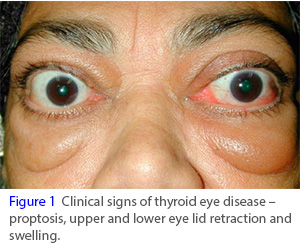
甲状腺眼病(TED)(图片来源:mister-sign.info)
甲状腺眼病(TED)是一种进行性的、致衰性的自身免疫性疾病,活动性疾病窗口有限,在此期间无需手术干预即可治疗。虽然TED经常发生在甲状腺功能亢进或格雷夫病(Grave’s disease,甲状腺机能亢进)患者身上,但它是一种独特的疾病,由自身抗原激活眼眶内细胞上IGF-1R介导的信号复合物引起。这会导致一连串的负面效应,造成长期的、不可逆转的损害。活动性TED持续长达3年,其特征是眼后炎症和组织扩张。随着TED的进展,它会造成严重的损害,包括眼睛突出(眼球突出)、斜视(眼球错位)、复视(两个视觉),并且在某些情况下会导致失明。
目前,患者必须经历活动性TED,直至疾病变得不活跃(这通常会留下永久性和视力受损的后果),然后才能进行复杂而昂贵的手术,但手术可能永远无法恢复视力或外观。TED患者经常经历长期的功能、心理和经济负担,包括不能工作和从事日常生活活动。
Tepezza的活性药物成分teprotumumab是一种全人IgG1单抗,靶向胰岛素样生长因子-1受体(IGF-1R),开发用于中度至重度甲状腺眼病(TED)的治疗,该病通常与格雷夫病(Grave’s disease,甲状腺机能亢进)相关。OPTIC研究中,接受teprotumumab治疗的患者眼球突出发生了前所未有的减少,而这目前只有在活动性疾病结束后才能通过手术治疗。
Horizon公司预计将在未来几周在美国市场推出Tepezza,该药上市后,将为临床医生提供第一种药物,在活动性TED期间除了治疗其他痛苦的症状之外,来减少眼球突出。
该公司还将开展一项上市后研究,在更大的患者群体中评估Tepezza的安全性,正如2019年12月13日DODAC会议上所讨论的。这项研究还将评估复治率与患者治疗时间长短的关系。
-
并购
-
会议会展










