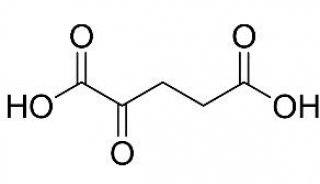
碳酸酐酶IX锚定的铼光敏剂诱导细胞焦亡激活抗肿瘤免疫
为达到良好的抗肿瘤免疫效果,理想的抗肿瘤治疗不仅要破坏原发肿瘤,还要提高肿瘤微环境的免疫原性。近年来,光动力治疗(PDT)被证明也能产生免疫刺激,但肿瘤组织缺氧及极低的免疫原性严重制约了PDT过程中适应性免疫的充分激活。故此,迫切需要开发在缺氧条件下仍具有较高的光动力效率、并能有效增强肿瘤免疫原性的新型光敏剂。
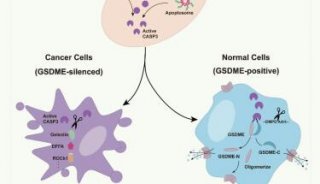
近日,中山大学的毛宗万教授(点击查看介绍)团队设计开发了碳酸酐酶IX(CAIX)靶向锚定细胞膜的铼(l)光敏剂CA-Re,不仅在缺氧肿瘤中表现出纳摩尔级的光毒性,还能通过诱导gasdermin D(GSDMD)介导的细胞焦亡增强肿瘤细胞的免疫原性,进而在体内有效激活抗肿瘤免疫应答,最终能够同时消灭原发肿瘤与远端肿瘤。
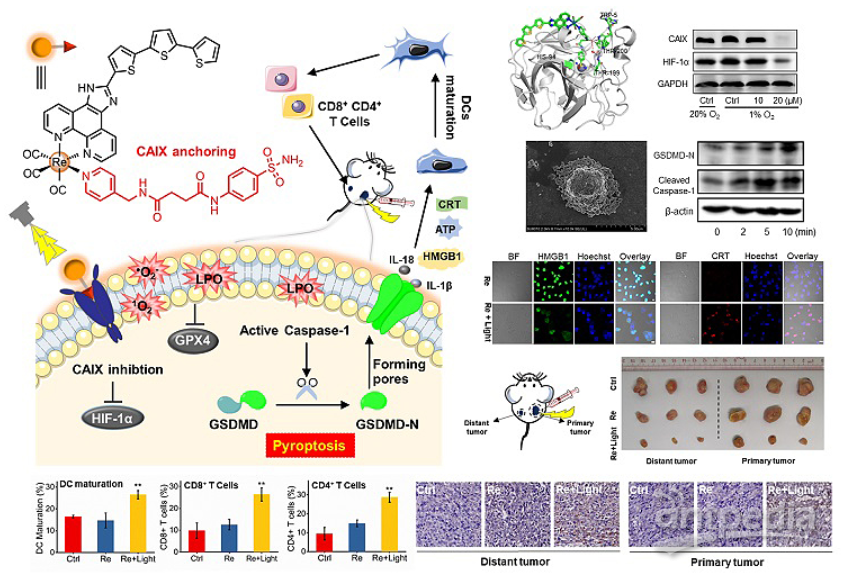
如图所示,该八面体铼金属配合物具有较长的三重态寿命1200 nS,其修饰的较低能级三噻吩配体使其单线态氧产生敏化;其配体之间电荷转移(ILCT)可能参与了与氧或生物分子的分子间电荷转移反应,从而促使其光动力产生各种ROS。CAIX锚定特性赋予CA-Re长时间(> 24 h)滞留在细胞膜上的能力,进而在光照条件下能够原位损伤细胞膜并产生大量的脂质过氧化。细胞毒性实验表明CA-Re具有很低的暗毒性(darkIC50 > 100 μM)和纳摩尔级的光毒性(lightIC50 = 7.3 ± 0.1 nM),即使在缺氧肿瘤中其光毒性仍低至纳摩尔级别(lightIC50 = 20 ± 0.6 nM),实现对缺氧肿瘤高效的光动力治疗效果。同时,通过共聚焦与扫描电镜对细胞形貌进行表征、并结合western blot实验证明,经过CA-Re光动力处理的肿瘤细胞发生了GSDMD蛋白介导的焦亡、细胞膜完整性被破坏。而光动力诱导的焦亡促使一系列炎症因子和细胞损伤相关分子如CRT、HMGB1等的释放,显著增强了肿瘤细胞的免疫原性,促进树突细胞的成熟化和抗原递呈能力,进而在体内充分激活T细胞依赖的适应性免疫应答,增加了肿瘤浸润的毒性T细胞(CD8+)和辅助T细胞(CD4+)表达,最终能够同时消灭原发肿瘤与远端肿瘤。
金属配合物的免疫调节机制是金属化学生物学领域尚未解决的重要科学问题之一,其激活抗肿瘤免疫反应的控制因素和构效关系也不明晰,该工作是报道的首例基于金属配合物的焦亡诱导剂,为未来有效的金属免疫治疗的发展提供了关键信息。
相关结果发表Angewandte Chemie International Edition 上,文章的第一作者是中山大学化学学院的博士研究生苏绪贤,毛宗万教授和曹乾副教授为该论文共同通讯作者。