ACE HILIC色谱柱方法开发指南Ⅰ - HILIC的优劣势剖析
引言
亲水作用色谱(HILIC)采用与反相液相色谱(RPLC)类似的洗脱液,为亲水性或极性到(至)极性很强的分析物提供了适宜的保留和分离替代方法(适宜的保留和分离提供了替代方法)。
RPLC的特征在于保留较少或无保留,所以这类亲水性分析物(log P 值约为零或更小的那类分析物)的保留是一种挑战(这些亲水性的分析物(log P 值约为零或更小的那类分析物)的保留对于RPLC是一个挑战,因为用反相色谱方法这些分析物只具有很少的保留或者没有保留)。
ACE HILIC色谱柱为亲水性分析物提供了RPLC的替代选择,无需使用诸如离子对试剂等添加剂。
多年来,比较常见的是采用高有机物含量的洗脱剂与水性组分结合使用(采用高有机含量的洗脱剂与水性组分结合是常见的HILIC方法),但HILIC一词最早是在20世纪90年代[1]首次被提出用来代表极性分析物保留和分离所用的富含有机溶剂的洗脱剂(描述富含有机溶剂的洗脱剂用来保留和分离极性分析物)。
作为一种技术,HILIC已经应用到了几乎所有的色谱应用领域,并且经证明可有效用于临床分析、食品和饮料应用、以及制药行业和蛋白质组学,这些领域中,极性到(至)极性很强的分析物的保留和分离仍然是一项挑战。
色谱法所用HILIC的主要优势
HILIC可对极性到极性很强的分析物进行(提供)保留
作为一般的实用经验法则,如果RPLC模式下分析物在咖啡因之前洗脱(log P~零(约为0)),则可能更适合HILIC分离模式。
如果RPLC模式下分析物在咖啡因之后洗脱,则更适合RPLC。
图1示出了(表示)一种含有草甘膦(log P = -2.39)、咖啡因(log P = -0.13)和阿米替林(log P = 4.90)的混合物的RPLC梯度色谱图。
图1的顶部显示的是一个近似值,HILIC和RPLC模式可在log P尺度内运行和重叠(显示在Log P尺度下HILIC和RPLC模式操作和重叠的一个近似位置)。
很明显,极性很强的分析物草甘膦会在RPLC模式下的柱头塌陷附近洗脱,并且(表明)它非常适合HILIC。
RPLC模式可保留咖啡因(咖啡因可以使用RPLC模式),但也可使用HILIC。RPLC与HILIC之间的重叠区域常常会引发讨论,因为两种模式都具有优势:选择通常都是由应用导向(已有应用决定)。
阿米替林是最适合RPLC的疏水性分析物(疏水性分析物最适合用RPLC)。
如果分析物的log P特性未知,运行在RPLC模式(如图1所示)下的广泛搜索梯度常常可以帮助确定近似分析物的(的分析物)亲水性/疏水性,同时可指示最适合的分离模式。
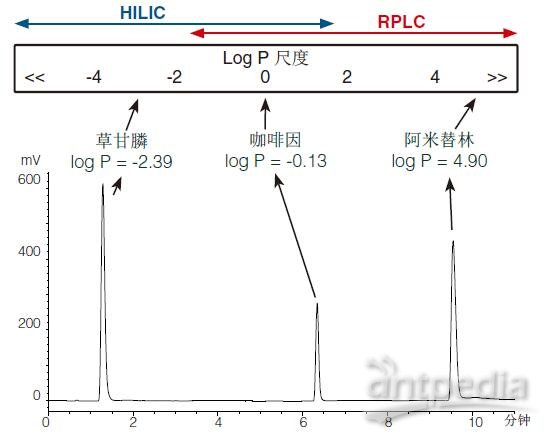
图1
HILIC和RPLC操作范围和重叠的实际演示
色谱柱:ACE 2 C18, 100 x 3.0 mm
流动相:A = 10 mM 甲酸铵,pH 3.0 (aq) B = 10 mM 甲酸铵,pH 3.0 in MeCN:H2O (90:10 v/v)
梯度:5-100%B(10分钟)
检测:ELSD
流速:0.4 mL/min
温度:30ºC
进样:10 μL
使用VWR-Hitachi进行分析Chromaster(带VWR ELSD90)
HILIC为RPLC提供了替代选择
HILIC第二个优势特性在于:它通常能为RPLC提供互补或正交选择,如图2中所演示。
HILIC模式(图2b)下,六种极性分析物的混合物的洗脱图(洗脱情况)与采用RPLC分析的相同混合物正好相反,证明HILIC具有正交选择性。
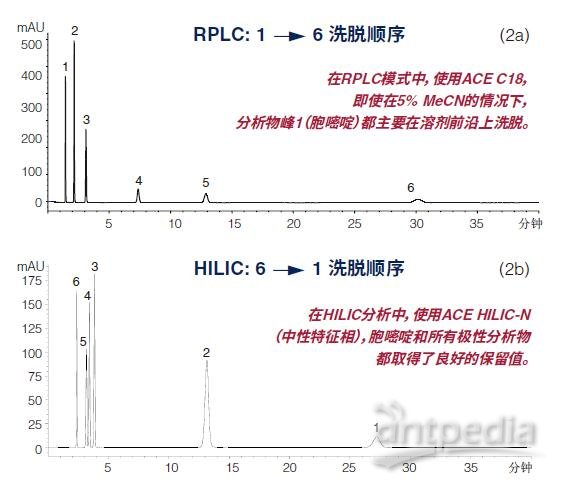
图2
RP与HILIC之间的正交选择性
(a)柱:ACE 5 C18, 150 x 4.6 mm
流动相:0.1%醋酸(溶于乙腈/水中)(5:95 v/v)
(b)柱:ACE 5 HILIC-N,150 x 4.6 mm
流动相:0.1%醋酸(溶于乙腈/水中)(95:5 v/v)
流速:1 mL/min
温度:22 °C
检测:UV, 254 nm
进样:5 μL
样品:
1) 胞嘧啶
2) 次黄嘌呤
3) 胸腺嘧啶
4) 可可碱
5) 茶碱
6) 咖啡因
选择性是色谱分析中分析物析出(分辨率)的关键,因此可利用HILIC最大化极性到极性很强的分析物的选择性(对于极性到强极性化合物,可利用HILIC最大化选择性)。
在方法开发过程中,利用选择性是了解分析物保留行为的第一步,同时也是增加观察到样本(样品)内所有种类可能性的一种有效工具。
不同且复杂的HILIC多模式保留机制为RPLC提供了一种理想的互补选择性分离模式。
HILIC使用高有机物含量的洗脱剂
第三个优点源于HILIC模式下使用的高有机物含量的洗脱剂。
结果表明:与RPLC相比,其快速扩散系数可达RPLC的两倍,从而可强化传质和减轻C项对范第姆特方程(减小范特姆第方程C相) [2]的作用。
但是,HILIC中的流动相必须包含至少3%的水性物质,以(因需)在固定相粒子周围形成吸附水层以便分散开(分配)。非质子有机溶剂乙腈通常用作HILIC中较弱的溶剂。
此外,HILIC洗脱剂对MS检测[3]也有帮助。
有机溶剂含量非常高,可实现理想的低表面张力(高的有机溶剂含量可提供一个理想的低表面张力),并为MS源提供高挥发性的液体流,从而改善去溶剂化和离子形成的条件,因此增强了信号响应。
HILIC分离通常可提供较低的背压
通常,HILIC模式下的色谱柱(和体系(系统))背压比水-有机的RPLC洗脱剂更低(尤其是当主要使用最常用的乙腈时)。
这为色谱工作人员提供了一个选择:在流速更高、甚至多组色谱柱结合(串联使用)的情况下,都可以使用更小、更高效的粒子,增加了平板计数(理论塔板数)或峰容量,同时背压[4,5]也适度(在背压合适的情况下,增加了平板计数(理论塔板数)或峰容量 [4,5])。
色谱法所用HILIC的主要劣势
HILIC法的稳定性
这是一个经常讨论和报道的HILIC相关(与HILIC相关的)主题。
许多问题可以通过使用前足够平衡的HILIC色谱柱的方式解决。
如果HILIC法包含一个梯度(梯度洗脱),那么进样之间也需要足够的平衡。
样本溶解性
由于其本身的性质,极性到极性很强的分析物很难溶解在有机物含量丰富的溶剂中并持续保持溶解状态(在含有大量有机物的溶液中很难溶解以及保持溶解状态)。