交联聚乙烯基吡咯烷酮快速前处理方法结合液-...(一)
交联聚乙烯基吡咯烷酮快速前处理方法结合液-质分析红葡萄酒中酪蛋白过敏原
张伟1 贺艳2 刘伟2 吴智渊1 江峥1 许泓2
王勇为1 张裕君2 郑文杰*2
1(赛默飞世尔科技(中国)有限公司,上海201206)
2(天津出入境检验检疫局动植物与食品检测中心,天津300461)
摘要 建立了红葡萄酒酪蛋白过敏原的质谱分析方法。选择专一性SRM 离子对,建立3 种亚型酪蛋白α-S1, α-S2, β的质谱定性与定量方法;利用交联聚乙烯基吡咯烷酮(PVPP)处理红葡萄酒有效提取蛋白,并直接快速酶解,使前处理缩短到2 h以内。结果表明,酪蛋白的回收率提高到80%以上,检出限达10 μg/ L。
关键词 红葡萄酒; 酪蛋白; 过敏原; 前处理; 液相色谱-串联质谱
1引言
引起过敏的物质称为过敏原,一般为蛋白质类物质。随着食物过敏患者的增多,以及可能导致过敏性休克甚至死亡等严重后果,已建立了一系列针对过敏原的法规及检测方法,包括核酸法(PCR)和酶联免疫法(ELISA)等。新兴的质谱法(MS)灵敏度高、假阳性概率低,并具有方法开发快速、运行成本低等优势。
葡萄酒酿造过程中需要加入澄清剂去除沉淀物质,使酒液获得长期稳定性。酪蛋白是常用的澄清剂之一。酪蛋白是一种来源于牛乳的过敏原,残留在葡萄酒中会对过敏人群产生危害。但是葡萄酒,特别是红葡萄酒含有大量单宁等鞣质,单宁与蛋白质之间存在多点疏水键和氢键的作用,有很强的蛋白结合能力。单宁常用作酶抑制剂使酶失活。单宁极大地抑制了葡萄酒蛋白的提取与酶解,传统蛋白提取方法(超滤、透析、有机溶剂沉淀等)用于葡萄酒时回收率只有20% ~30%[1,2] 。因此,关于葡萄酒过敏原质谱分析的报道很少,研究对象也集中在单宁含量很低的白葡萄酒,对于含有大量单宁的红葡萄酒的前处理和质谱分析仍无成熟的策略[3,4] 。已报道的方法如十二烷基硫酸钾(KDS)法、聚乙烯基吡咯烷酮(PVP)法等,提取后蛋白仍需要电泳去除单宁和两性电解质,工作量大,分析通量低,蛋白质的回收率很低[5,6] 。
交联聚乙烯基吡咯烷酮(PVPP)是PVP 交联后形成的颗粒(约110 μm),具有很强的吸附能力[7] 。PVPP 竞争性地与单宁结合,释放蛋白,可以有效去除单宁等多酚类物质[8,9] 。本研究利用PVPP 建立了快速、高效的红葡萄酒蛋白提取与酶解方法,使前处理时间缩短到2 h 之内,回收率达到80% 以上。将本方法与三重四极杆液相色谱-串联质谱联用(LC-MS/ MS)结合,分析了红酒中3 种亚型的酪蛋白,检出限达到10 μg/ L,比目前报道的方法提高了至少一个数量级[3] 。
2实验部分
2. 1 仪器与试剂
TSQ Vantage 三重四极杆质谱、Ultimate 3000 超高效液相色谱( Thermo 公司)。α-酪蛋白(α-Casein)、 β-酪蛋白( β-Casein)、胰蛋白酶(Trypsin)、PVPP、NH4HCO3 购自Sigma-Aldrich 公司;乙腈、甲酸购自Fisher 公司;红葡萄酒商品若干。
2. 2 蛋白提取与酶解
样品制备:取红酒200 μL 与酪蛋白混合溶液4 μL(α-酪蛋白、 β-酪蛋白各5 μg/ L)充分混匀后(添加量为100 μg/ L 时),加入200 μL PVPP 混悬液(100 g/ L,溶于0. 5 mol/ L NH4HCO3 溶液),并于30 益振荡反应15 min。反应后,直接加入2 μL Trypsin (200 μg/ L),并于37 益振荡酶解1. 5 h。
酶解完成后,于20000 g 离心5 min,取上清液。沉淀加入100 μL 水,振荡超声2 min,再于20000 g下离心5 min,将溶液完全取出。两次溶液合并后,再次20000 g 离心,取上清液直接进样分析。
对照品制备:第一步不加酪蛋白,前处理完成后、进样前,再加入Trypsin 酶解后的酪蛋白混合溶液4 μL(α-酪蛋白、 β-酪蛋白各5 mg/ L ,添加量为100 μg/ L), 混匀后直接进样分析。
2. 3 LC-MS / MS 分析
色谱条件:Hypersil GOLD aQ 色谱柱(100 mm 伊2. 1 mm, 1. 9 μm); 上样量:10 μL; A 相:0. 1% 甲酸溶液; B 相:0. 1%甲酸-乙腈溶液; 流速:300 μL/ min; 分析梯度:0 ~2 min, 5% B; 2 ~12 min, 5% ~95% B; 12 ~17 min, 95% B, 17 ~18 min, 95% ~5% B; 18 ~23 min, 5% B。
质谱条件: 扫描模式: SRM,正离子; 喷雾电压: 3000 V; 气化温度: 300 益; 鞘气压: 206. 85 kPa;辅助气压(Arbitrary units): 10; 离子传输管温度: 350 益; 碰撞气体(Ar): 0. 20 Pa (1. 5 mTorr); Q1/Q3 分辨率(FWHM): 0. 7; 驻留时间: 0. 04 s; 离子对及碰撞能量见表1。
2. 4 数据处理
酪蛋白亚型序列来自Swiss-Prot 数据库; 专一性肽段与特征性碎片选择及碰撞能量优化由PinPoint软件(Thermo)分析,结合LTQ-Orbitrap 高分辨质谱(Thermo) 全扫描确证获得; 质谱数据由Xcalibur Qual Browser 软件(Thermo)进行定性分析,由Xcalibur Quan Browser 软件(Thermo)进行定量分析。
3结果与讨论
3. 1 酪蛋白LC-MS / MS 方法建立
酪蛋白有α和 β两种主要亚型,其中α包含S1 和S2 两种亚型。由于α-S1, α-S2 和 β三者序列完全不同,并同时具有致敏性,因此同时针对这3 种酪蛋白建立LC-MS/ MS 分析方法。根据Pinpoint 软件分析,从3 种酪蛋白中分别选择两条特征性肽段,每条特征性肽段分别选择两个子离子,即每种亚型对应4 对离子对,并获得相应的优化碰撞能量(表1)。为了确定离子对选择的准确性,进一步通过LTQ-Orbitrap高分辨质谱对酪蛋白酶解产物进行了数据依赖性扫描分析,验证了离子对选择的合理性(图1)。
表1 酪蛋白特征性肽段及SRM 离子对选择
Table 1Unique peptides of casein and design of selective reaction monitoring (SRM) transitions
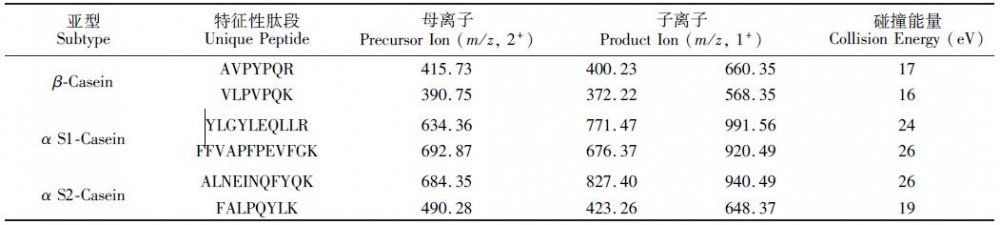
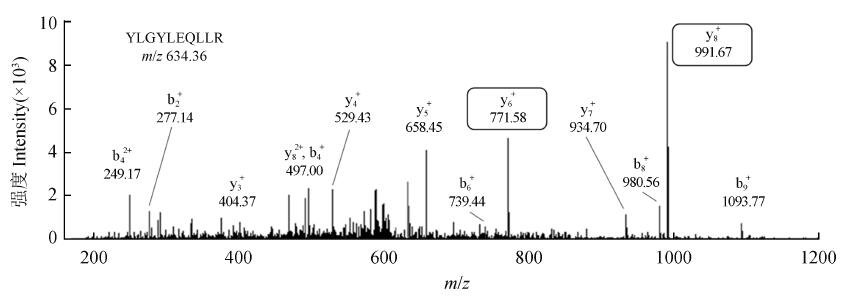
图1 αS1-酪蛋白YLGYLEQLLR 肽段MS/ MS 谱图
Fig. 1 MS/ MS spectrum of peptide YLGYLEQLLR from αS1-Casein
-
综述

-
科技前沿

-
焦点事件