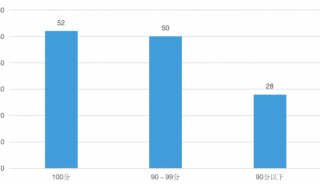
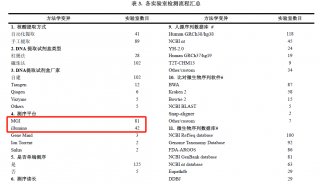
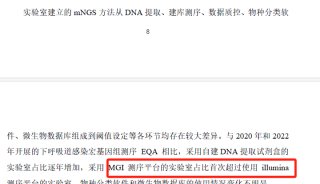
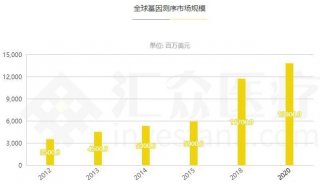
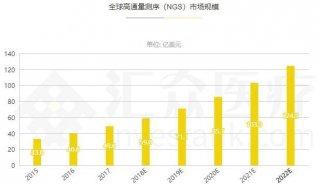
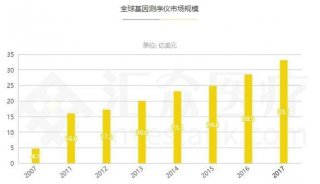
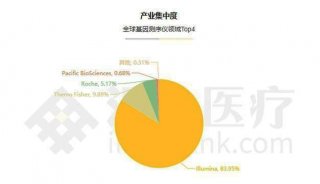
Illumina总部积极推进CFDA认证以应对中国监管新规
基因测序仪器公司Illumina中国分公司今日(27日)在北京举行"NGS创新开发者大会”。健康界在会上获知,该公司二代测序平台 MiSeqDx正在积极申请国家食品药品监督管理总局(China Food and Drug Administration,CFDA)认证,预计近期会获得明确结果。
今年2月9日,CFDA与国家卫生计生委联合发布了《关于加强临床使用基因测序相关产品和技术管理的通知》(食药监办械管〔2014〕25号)(以下简称“《通知》”)。《通知》规定,基因测序诊断产品(包括基因测序仪及相关诊断试剂和软件)将纳入医疗器械管理,并应按照《医疗器械监督管理条例》及相关产品注册的规定申请产品注册;未获准注册的医疗器械产品,不得生产、进口、销售和使用。同时,使用上述产品在医疗机构开展基因测序临床诊断业务,还必须经过卫生计生行政部门批准技术准入方可应用。《通知》要求,不符合上述规定的应用,“必须立即停止”。
Illumina中国分公司市场部经理刘雪燕表示,《通知》出台后,美国总部对中国分公司向CFDA申请产品注册给予了非常高效的支持。
2013年11月19日,Illumina公司宣布,其MiSeqDx系统已获得美国食品和药品监督管理局(U.S.Food and Drug Administration,FDA)的上市前许可,成为首个获得FDA许可的高通量DNA测序仪。
推荐