Cell重磅:中国科学家揭示肝癌3种分型和发病机制
肝癌是我国最常见的恶性肿瘤之一,主要包括两种病理组织学类型,分别为肝细胞癌(hepatocellular carcinoma,HCC)和肝内胆管细胞癌(intrahepatic cholangiocarcinoma,iCCA),HCC占我国肝癌总数的83.9% ~ 92.3%。慢性乙肝病毒(hepatitis B virus,HBV)感染是导致我国肝癌发生的最主要原因,约85%的肝细胞癌患者携带HBV感染标志【1】。TCGA(The Cancer Genome Atlas)等基因组研究工作广泛揭示了HCC的遗传学图景【2-4】,初步阐明了肝癌的关键基因和信号通路,但并非所有癌症的DNA水平变异都具有明确的生物学意义。肝癌的发生发展是一个多步骤过程,受到机体的系统性调控,尤其对于感染HBV的肝癌,基因突变会对表型产生怎样的影响,相关的研究报道较少。
2019年10月3日,复旦大学附属中山医院樊嘉院士、中国科学院上海药物研究所周虎研究员及中国科学院生物化学与细胞生物学研究所高大明研究员研究组合作在Cell上发表题为Integrated Proteogenomic Characterization of HBV-related Hepatocellular Carcinoma的论文。该研究对159例感染HBV的中国HCC病人的肝细胞癌(Chinese HCC patients with HBV infection,CHCC-HBV)和配对癌旁肝组织样本进行了蛋白基因组(proteogenomics)研究,通过检测和整合分析基因突变、拷贝数变异、基因表达谱、蛋白质组及磷酸化蛋白质组等多维度组学数据,较为完整地揭示了肝癌肿瘤细胞的分子特性,全面解析了肝癌的发生和发展机制,为肝癌的精准分型与个体化治疗、疗效监测和预后判断提供了新的思路和策略。

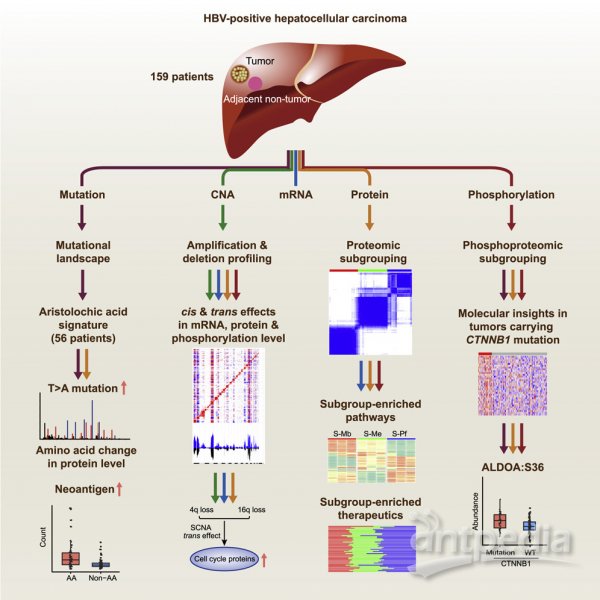
图1 HBV相关HCC蛋白基因组研究概览
本研究首先通过解析编码基因突变图谱揭示了159例肝癌患者的高频突变基因,包括TP53(58%)、CTNNB1(19%)、AXIN1(18%)、KEAP1(7%)和RB1(6%)。与TCGA报道的HBV相关HCC病人队列相比,CHCC-HBV病人队列中AXIN1(18% vs 8%)、TSC2(7% vs 0%)、SMARCA2(5% vs 0%)、ATRX(5% vs 0%)和KMT2C(8% vs 0%)突变频率偏高,而CTNNB1(19% vs 35%)、ARID1A(10% vs 16%)和RB1(6% vs 16%)突变频率偏低,提示我国HBV相关HCC人群具有与西方国家不同的基因突变频谱。由于我国相当一部分乙肝患者曾服用中药治疗,而根据近年来的报道中草药含有的I类致癌物马兜铃酸(aristolochic acids,AA)可引起肝脏细胞基因组损伤和产生特殊的基因突变指纹,并有可能促进肝癌的发生发展【5】。经研究发现,本队列中约1/3的肝癌样本中含有马兜铃酸相关的基因突变“指纹”(AA signature),这是目前报道的含有马兜铃酸突变“指纹”的最大样本量的肝癌队列。同时,利用蛋白质组数据也检测到了由马兜铃酸基因突变“指纹”编码的变异蛋白。有意思的是,马兜铃酸的突变“指纹”与肿瘤突变负荷(tumor mutational burden,TMB)、肿瘤新抗原(neoantigen)、微环境免疫耐受(如CD8+ T细胞浸润,ICOS、OX40、PD-L1和LAG3等免疫检查点丰度)显著相关,提示了对该类肝癌患者应用免疫治疗可能会有特殊的疗效。
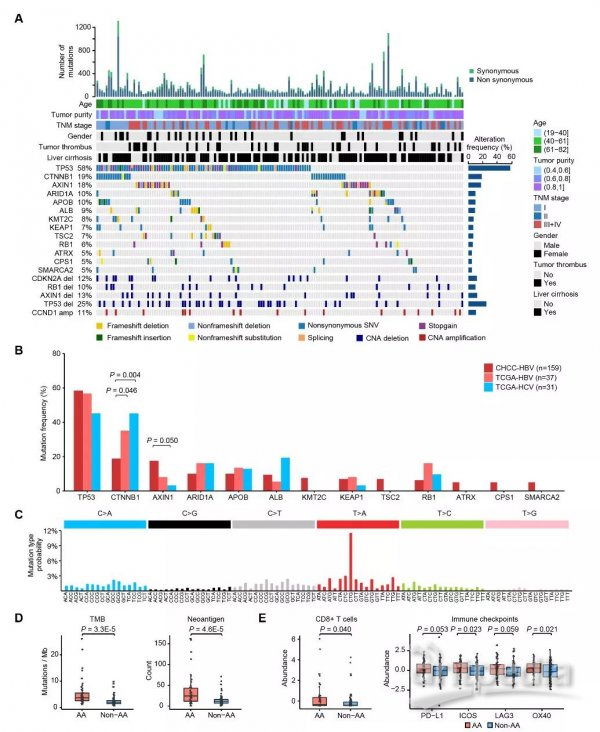
图2 HBV相关HCC基因突变解析
本研究发现可以根据蛋白质组数据将HBV相关HCC分为三个亚型,分别为代谢驱动型(metabolism subgroup,S-Mb)、微环境失调型(microenvironment dysregulated subgroup,S-Me)和增殖驱动型(proliferation subgroup,S-Pf),这三个亚型与基因组稳定性、癌栓有无、甲胎蛋白(alpha fetoprotein,AFP)丰度及RB1和TSC2基因突变等特征显著相关。更重要的是,三个亚型的临床预后显著不同,其中代谢驱动型(S-Mb)的肿瘤中代谢相关蛋白(如ACAT1、ADH1A、G6PC和PGM1等)相对高表达,提示其保留了部分正常肝功能,预后最好;增殖驱动型(S-Pf)的肿瘤中增殖相关蛋白相对高表达(如PARP1、TOP2A、PCNA和MKI-67等),预后最差;微环境失调型(S-Me)的肿瘤中免疫、炎症和基质相关蛋白相对低表达(CD4、CD8A、S100A12、SPARC和ITGB3),其患者预后介于增殖驱动型与微环境失调型之间。值得指出的是,对于36例蛋白分型和mRNA分型归类不一致的样本,蛋白分型可以提供更好的预后分离效果(蛋白分型HR=2.194 vs mRNA分型 HR=1.065)。而且,基于蛋白质组的分子分型的预后价值不依赖于临床上常用的TNM分期,有望为肝癌的分子分型、个性化精准治疗和临床预后判断提供指导(图3)。
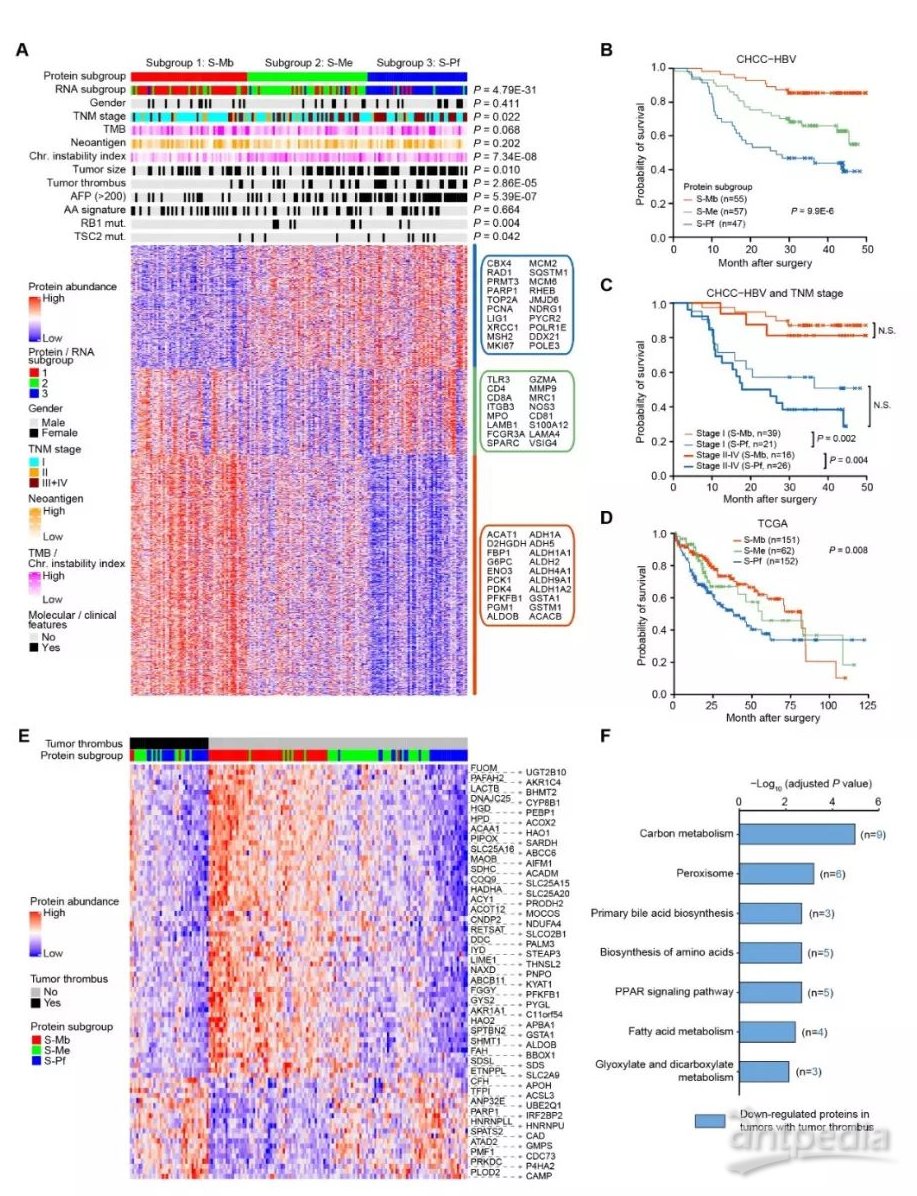
图3 HCC三个亚型与预后显著相关
通过监督学习(supervised-study)方法,研究人员鉴定到两个与预后显著相关的蛋白质PYCR2和ADH1A。PYCR2是参与脯氨酸合成的关键酶,与癌旁肝组织样本相比,在癌组织中显著高表达,且表达越高预后越差;ADH1A参与肝脏的氧化还原-解毒代谢功能,在癌组织中显著低表达,且表达越低预后越差。该研究利用独立于本研究的组织芯片(含有243个HBV-HCC样本)进行多色免疫荧光分析,验证了PYCR2和ADH1A表达与预后的相关性,说明其具有潜在的临床预后指示应用价值。
该研究还发现,HBV编码的mRNA和蛋白质在癌组织样本中表达低于癌旁组织。SLC10A1是肝脏特异表达的胆汁酸转运蛋白,同时也是HBV感染肝细胞的受体。研究发现SLC10A1表达水平在癌组织中显著降低,并与病人的预后相关,表达越低预后越差。根据报道,HBV编码基因的转录及胆汁酸代谢相关基因的表达由同一套转录因子(FXR、RXR等)调控,这些转录因子在肝癌组织中的低表达会同时导致胆汁酸代谢受阻和HBV基因表达下调,因而是肝癌组织不同于癌旁组织的一个重要分子特征。作者还发现,参与肝脏器官特异性代谢的蛋白质在肿瘤中表达下调,主要包括参与糖异生、解毒和尿素-氨代谢等肝脏特异性的代谢通路。而参与肿瘤细胞增殖相关代谢的蛋白质,如胆固醇代谢的关键酶(SOAT1、SOAT2和HMGCR等)和谷氨酰胺代谢相关蛋白(GLS和GLUD2),在肿瘤中表达上调。这些数据提示了在HBV相关HCC中,肝脏器官特异性代谢功能的丧失及肿瘤细胞代谢重编程的激活(图4)。
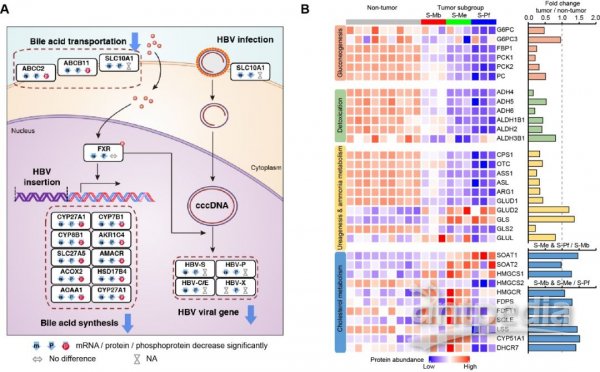
图4 感染HBV的HCC的特异性分子特征
最后,该研究还利用多组学数据系统性检测了细胞代谢和信号通路在肝癌中的变化规律。代谢途径方面,发现糖酵解和脂肪酸代谢在癌组织中整体上调,而胆汁酸代谢整体下调;而癌组织中的WNT、Hippo-YAP、mTOR信号通路没有表现出整体性的上调,而磷酸化smad2/3信号在多数癌组织中上调,提示TGF-β信号通路的激活是HBV相关HCC中一个较为普遍的特征。
该研究还重点关注了肝癌中最重要的基因突变之一,CTNNB1突变型和野生型肝癌在蛋白质和磷酸化位点上的差异,并发现CTNNB1突变与果糖二磷酸醛缩酶A(ALDOA)第36位丝氨酸(Ser36)的磷酸化相关。而进一步的体内外功能研究表明,ALDOA磷酸化促进了肝癌细胞的无氧糖酵解代谢,并可以显著促进肝癌细胞的的增殖及裸鼠体内成瘤,且在过表达突变型CTNNB1的肝癌细胞中敲减ALDOA可以更显著地抑制细胞增殖。因此,ALDOA可能是靶向存在CTNNB1突变肝癌的一个重要潜在靶点。
综上所述,该工作对中国人群的大队列HBV相关HCC样本进行了深入的蛋白基因组研究,为深入理解肝癌的发生发展机制和推进肝癌的临床精准诊疗提供了重要的数据及理论支持。这也是继年初贺福初院士团队与樊嘉院士团队在Nature发表运用蛋白组学方法发现早期肝癌新药物靶点的研究(专家点评Nature丨中国科学家发现肝癌精准治疗新靶点——开启蛋白质组学驱动的精准医学新时代)【6】之后,我国科学家运用系统生物学技术在肝癌研究领域的最新力作。
据悉,樊嘉院士、周虎研究员和高大明研究员为本文共同通讯作者,中山医院高强教授、中国科学院上海药物研究所朱洪文博士、中山医院董良庆博士、至本医疗施巍炜博士及中国科学院生物化学与细胞生物学研究所博士研究生陈然为本文共同第一作者。这项工作得到了美国国立癌症研究院Henry Rodriguez教授、美国贝勒医学院章冰教授、华盛顿大学基因研究所Li Ding教授、美国西奈山伊坎医学院Pei Wang教授的大力支持。
https://doi.org/10.1016/j.cell.2019.08.052
参考文献
1 Prevention of Infection RelatedCancer Group, S. C. o. C. P. et al.[Strategies of primary prevention of liver cancer in China: Expert Consensus(2018)]. Zhonghua zhong liu za zhi[Chinese journal of oncology] 40,550-557, doi:10.3760/cma.j.issn.0253-3766.2018.07.013 (2018).
2 Totoki, Y. et al. Trans-ancestry mutational landscape of hepatocellularcarcinoma genomes. Nature genetics46, 1267-1273, doi:10.1038/ng.3126(2014).
3 Schulze, K. et al. Exome sequencing of hepatocellular carcinomas identifiesnew mutational signatures and potential therapeutic targets. Nature genetics47, 505-511, doi:10.1038/ng.3252 (2015).
4 Cancer Genome Atlas ResearchNetwork. Electronic address, w. b. e. & Cancer Genome Atlas Research, N.Comprehensive and Integrative Genomic Characterization of HepatocellularCarcinoma.Cell 169, 1327-1341 e1323, doi:10.1016/j.cell.2017.05.046 (2017).
5 Ng, A. W. T. et al. Aristolochic acids and their derivatives are widelyimplicated in liver cancers in Taiwan and throughout Asia.Science translational medicine9,doi:10.1126/scitranslmed.aan6446 (2017).
6 Jiang, Y. et al. Proteomics identifies new therapeutic targets ofearly-stage hepatocellular carcinoma. Nature 567, 257-261,doi:10.1038/s41586-019-0987-8 (2019).