表面等离子共振检测蛋白相互作用实验
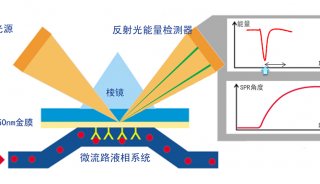
实验方法原理
实验材料 CM-5 葡聚糖芯片(BIAcore)配体蛋白靶蛋白
试剂、试剂盒 PBS胺-偶联试剂盒(详见「其他」)
仪器、耗材 BIAcore SPR 设备BIA 评估软件(point-and-click)
实验步骤
1. 插入一个新的 BIAcore CM-5 葡聚糖芯片。
2. 用 PBS 作为工作液以持续流动系统平衡系统。
3. 用实验确定最佳缓冲条件和浓度使非特异性结合到羧酸酯化葡聚糖上的靶蛋白和配体蛋白最小化。
对带有高度带负电荷的葡聚糖非特异吸收的配体可能变性,并且在溶液中可非特异性地结合靶蛋白。
4. 插入一张新的芯片。
5. 在 N-羟基琥珀酰亚胺(NHS)存在的情况下通过注入 1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)活化葡聚糖羧酸酯。
6. 在低 pH 的乙酸钠缓冲液中注入配体蛋白,使得葡聚糖上存在足够的蛋白量。同做几个平行实验,在这些平行实验中变化葡聚糖上配体蛋白的密度。
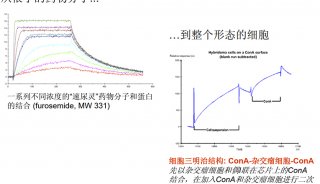
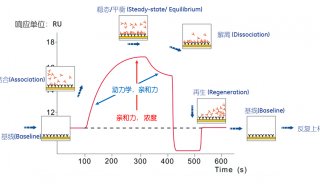
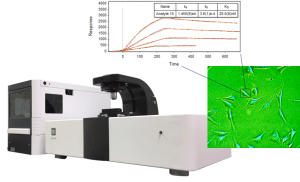
改变接触时间和蛋白质浓度,进行 7~14 步中的操作,然后检测目的蛋白从每个配体密度上分离的速率(步骤 15)。分离的速率应该是个常数并且不受配体表面密度的浓度影响。配体密度应该优化,以获得呈现产生清楚的结合反应的足够的分子表面。并且充分稀释以测量应该恒定的解离率常数。
7. 乙醇胺处理封闭所有没有反应活化的羧酸酯。
8. 在步骤 3 中确定的缓冲液条件和浓度范围内注入含有已知浓度的假设靶蛋白。
改变流速和分析物浓度以最小化扩散或者「大量输运」影响。结合速率常数对于某个特定反应必须是不变的。
9. 用实验方法确定再生条件,比如在什么条件下靶蛋白能够完全从共价结合的配体上解离。
10. 如果有必要的话,插入一张新的芯片。
11. 在最适的缓冲液条件和配体密度下重复步骤 2、5、6、7 和 8 中的操作(即活化右旋糖苷羧酸酯,共价结合感兴趣的蛋白质,封闭没有反应的位点以及向溶液中引入一个假设的结合蛋白)。
12. 使用步骤 9 确定的试剂再生。如要获得数据,则重复步骤 8 和步骤 12,使用至少三种不同浓度的靶蛋白。
13. 用 BIA 评估软件 point-and-click,计算分离率和结合率常数。用三个靶蛋白浓度所得的结合率和分离率的平均值计算平衡常数。
14. 颠倒实验设置:在先前的分析物固定、配体在溶液中的情况下实验,以证实动力学参数的相同性。
注意事项
其他
胺-偶联试剂盒(BIAcore)包含:
1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)
N-羟基琥珀酰亚胺(NHS)
乙酸钠缓冲液,低 pH
乙醇胺