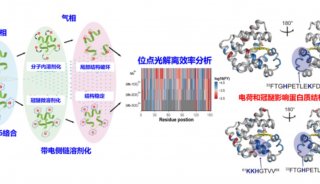
金黄色葡萄球菌ClpP水解酶的分子机制
上海药物所抗菌交叉团队研究人员针对金黄色葡萄球蛋白水解酶ClpP(SaClpP),开展水解功能的分子机制研究,继2011年在美国生物化学和分子生物学学会专业期刊《Journal of Biological Chemistry》上发表论文(J Biol Chem, 2011, 286, 37590-601)之后,研究论文再次发表于该杂志(J Biol Chem, 2013, 288, 17643–53)。
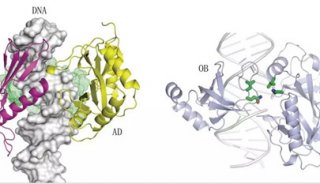
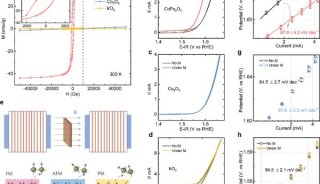
ClpP是细菌中关键的蛋白水解系统,由上下两个七聚体自组装成一个球形腔体,负责维持细菌体内蛋白质的稳态,对维系细菌的致病力起着关键作用。现有研究表明ClpP已成为一类针对新机制的抗菌新靶标,目前还没有靶向调控剂处于临床研究。
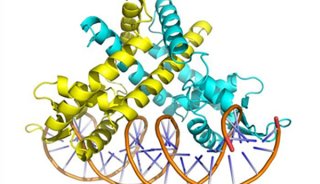
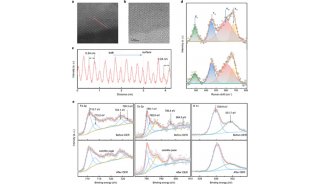
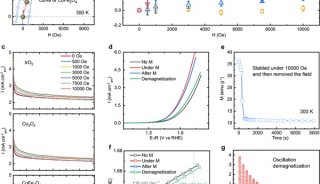
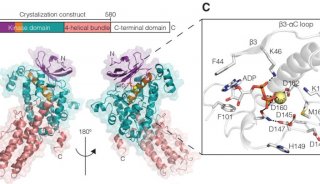
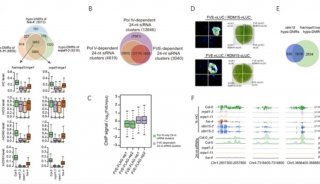
继该研究团队获得的SaClpP的两种功能构象:Extended和Compressed构象的基础上,罗成与杨财广研究员指导博士生叶飞和张婕,以长时间分子动力学模拟为导向,结合生化实验,阐明了SaClpP构象变化的具体路径和驱动力;利用分子动力学捕捉到了SaClpP在两种构象间转化的中间态Compact构型,通过晶体结构的解析肯定了该中间构象的存在和合理性;再通过理论模拟发现了构象变化过程中的数个重要位点(如A140、E137 等),得到了实验验证。
最终,这项研究通过理论模拟与实验验证紧密结合,阐明了SaClpP的动态调控机制:多肽底物进入ClpP空腔后被催化位点降解,降解产物在活性中心的积累造成局部分子间相互作用方式的改变,引起活性位点残基构象的变化,进而传递到附近的R171_D170网络,使得该网络中的相互作用也遭到破坏,Extended构型不能保持稳定,逐渐转变成Compressed构型,该构型被E137网络所稳定。在构象转化过程中,Extended构型中的Helix E通过解旋/再折叠的过程向Compressed构型转化,A140在Helix E上扮演了一个“转轴”的角色。
由于ClpP在不同细菌中高度保守,该研究结果对ClpP家族其它成员的结构及机制研究具有重要的参考意义,也为后续开展基于调控机制研究的化学生物学和抗菌药物发现研究奠定了坚实的理论和结构基础。
该研究得到了药物所抗菌交叉团队、基金委和科技部课题的资助,该研究也获得了中科院网络中心、天津和上海超级计算中心在计算资源上的支持。
-
投融资

-
企业风采

-
焦点事件

-
项目成果
-
科技前沿

-
科技前沿
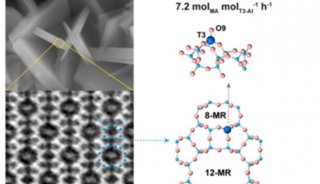
-
科技前沿
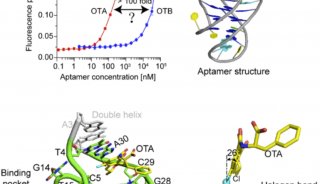
-
技术原理
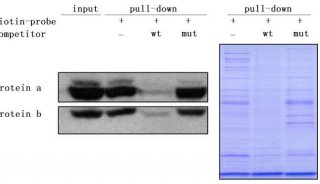
-
科技前沿
-
科技前沿
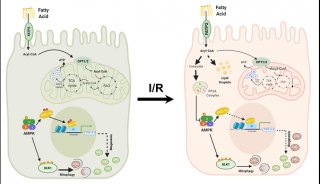
-
科技前沿
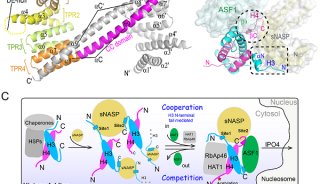
-
科技前沿
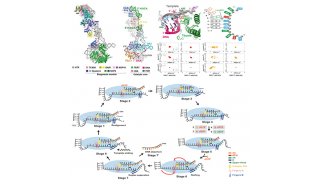
-
精英视角

-
科技前沿
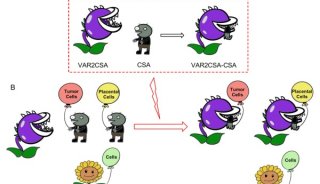
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿

-
综述
-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
焦点事件

-
项目成果
-
焦点事件

-
项目成果
-
项目成果
-
科技前沿
-
企业风采

-
项目成果
-
项目成果

-
焦点事件
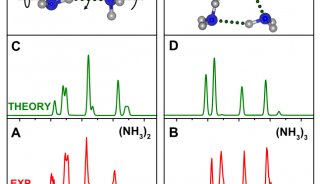
-
焦点事件

-
项目成果
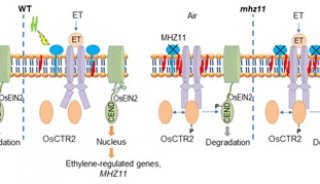
-
项目成果

-
项目成果
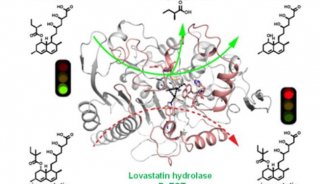
-
焦点事件

-
项目成果

-
项目成果
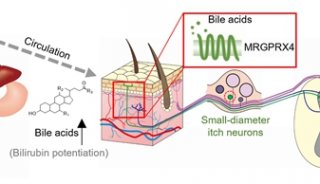
-
科技前沿
-
项目成果

-
科技前沿
-
科技前沿
-
科技前沿