动态光散射——胶体金是药物输送的黄金标准吗?
经过多年的投入,纳米技术已步入成熟。如今纳米医用材料正逐步出现在临床与医学实践中。从商业角度来说,这一悉心培育的研究成果使生物医学纳米技术市场产值突破700亿美元。而从实际应用来看,这意味着疾病靶向及治疗的方法可能会发生变革。
纳米级的胶体金在多重治疗与生物科技应用中具有很大潜力。以药物输送为例,通过控制胶体金独特的化学、物理和电子特性,研究人员能够开发出用于靶向药物输送的药物-纳米粒子复合物,提升药物在病变组织、癌细胞等特定生物目标中的生物分配和药代动力。因此,对创新细胞内输送媒介以及控制配方过程中的纳米粒子粒度而言,黄金纳米粒子便成为了一个重要平台,对于这项功能的定义至关重要。
本文阐述了检测颗粒大小在生物医学纳米技术中的重要性,并通过展示实验数据来说明如何利用先进的动态光散射(DLS)技术测量纳米级和亚纳米级的胶体金。
闪光之物:黄金疗法简史
自古时起,人们便认为黄金具有治疗特性。然而直到18世纪,含氰金盐的抗菌性才被发现。时光飞逝,百余年后的今天,金盐已被用于风湿性关节炎的常规治疗和控制。但在这些传统的治疗手段以外,现代人对黄金的胶体形态又燃起了新的兴趣。
胶体金的许多特性使其非常适合于多种纳米材料基质的临床应用。它的化学和物理惰性确保其在活体内安全无毒,而精细的粒度则使它能够在无损细胞的情况下穿过细胞膜。此外,悬浮在水介质中的黄金纳米粒子会形成带负电的离子,对蛋白质、抗体等生物大分子有很强的亲合性,使它们在离子的周围形成生物配体。目前,显像探针、诊断剂、高级药物输送等各种生物医学应用都在开发这些独特的物理特性。在高级药物输送这一领域中,利用黄金纳米粒子为口服胰岛素、先进基因疗法所需靶向抗癌药及DNA复合物等一系列传统和创新疗法提供尖端输送机制的研发活动也正在进行之中。
和所有的微粒疗法一样,胶体金复合物的生物利用度和临床疗效等药代动力学特性会在很大程度上受粒度影响。因此,控制胶体金的粒度是确保治疗方法在活体内符合疗效与安全标准的关键。颗粒表征是纳米粒子研发及质量控制中非常重要的一方面,为此需在配方的中间及最终阶段进行常规分析,以确保颗粒直径均匀,且分散中不存在聚集体。这需要一项强有力的分析技术,将整个样本内稳健可靠的颗粒表征与常规分析所要求的高效率相结合。作为一项满足此类行业需求的高效技术,动态光散射(DLS)的优势正在凸显。
引入动态光散射
在纳米粒子的开发中,有几种常规使用的颗粒表征技术。采用电子显微镜的颗粒显像技术已广泛用于细致了解系统内各个颗粒的结构与形态(图1)。然而,该技术存在的若干局限性限制了其在常规分析中的实际应用。
|
图1 从统计角度而言,在纳米粒子的均匀性与聚集研究中,仅仅依靠电子显微镜进行基于数量的粒度分布测量可能并不是一种好方法。 |
电子显微镜仅仅能够测量少数样本分布,且测得的是基于数量的粒度平均值。而胶体金产品由成千上万的颗粒组成,因此从统计角度来说,根据此类数据来推断产品的整体均匀性或聚集体浓度可能并不是好方法。即使出现低量的聚集体,临床疗效也会受影响,而且这通常还表示加工或配方存在问题,因此质量控制不能仅依靠电子显微镜。此外,用电子显微镜分析通常耗时长、强度大,既费成本又费人力。因此需要一项集合技术来做补充,以体积或质量为基准,确定整个分散体中的粒度分布,从而识别出不合规格的聚集体。
动态光散射(DLS)是一项非入侵式技术,通常用于分析分散粒子及胶态纳米粒子。DLS技术检测做无规则布朗运动的悬浮颗粒得到散射光强度随时间产生的波动。分析这些光强波动后便可以得到扩散系数,然后用斯托克斯-爱因斯坦方程算出颗粒大小。
近年来,DLS技术的一些进步已经提升了DLS测量在纳米级范围中的灵敏度和分辨率。例如,获得专利的非侵入式背散射(NIBS)光学仪器现已能在动态粒度范围内进行测量,可测颗粒直径在0.3nm至10微米之间,溶液浓度涵盖0.1ppm至40%w/v。用DLS技术进行数据采集速度快,不影响样本回收,无论在研究领域,还是质量控制中,都能够有效发挥作用。
以下案例分析探讨了DLS技术用于纳米粒子表征的优势。胶体金的实验数据重点说明了通过DLS技术获得的结果与电子显微镜技术之间的差别,以及如何借此更好地了解纳米粒子体系。
案例研究:使用DLS技术进行胶体金表征
实验利用高级DLS系统(英国马尔文仪器Zetasizer Nano S)对某一胶体金样本进行了测量。所有测量都在25℃时进行, DLS系统使用633nm激光光源,雪崩光电二极管(APD)作为光电探测器,检测散射光角度为173度。
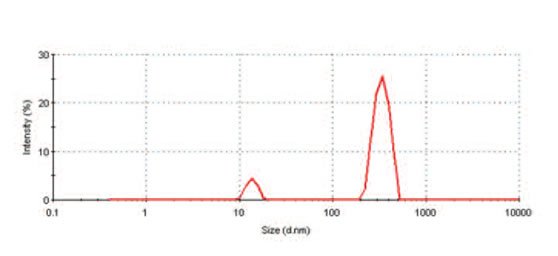
图2展示了胶体金样本的光强粒度分布。图中显示了粒子的光散射在不同粒度等级中所占的相对百分比。分别位于13.6nm和339nm处的两个不同峰值表示粒子呈双峰分布,说明样本内存在聚集体。
|
图2 胶体金样本的双峰光强粒度分布表明,样本内存在聚集体。 |
首先,从粒度分布峰值的相对光强来看,样本内似乎存在大量的聚集体。然而,将其转换成基于体积的分布时,如图2所示,显然实际上聚集体的浓度是相对较低的。这一转换由智能仪器软件实施,其中运用了米氏散射理论以及粒子的折光指数和吸收率。体积粒度分布显示,在单位质量内,绝大多数样本颗粒为13nm左右的小颗粒,且原始粒子与聚集体之比为9:1。
|
图3 以DLS技术分析的胶体金样本体积分布显示,超过90%的样本由13nm左右的小颗粒组成。 |
将基于体积或光强的粒度测量与基于数量的分析方法相比较,便会发现DLS技术与传统纳米粒子分析技术相互补充的价值所在。如图4所示,基于体积的分布转换成了基于数量的分布。由于样本所含的聚集体极少,因此数量分布为单峰,峰均值为12.4,且仅考虑了原始粒子。该结果表明,如果用电子显微镜等技术对该样本进行表征,所呈现的大部分颗粒将会是小颗粒,因而难以准确地推断出聚集体的整体浓度。
|
图4 以数量分布测量粒度、生成原始颗粒的单峰分布图。 |
动态光散射分辨率相对低于电镜技术,通常来讲如果颗粒粒径相差三倍或者更多,可以通过动态光散射技术得到分开的分布峰。然而,通过智能数据解读,我们还是可以了解到相当多的样品的粒径分布信息。比如,当单个颗粒与由2、3或4个颗粒组成的聚集体相混合时可能会产生一个宽峰。由于较大的颗粒散射了大部分光,因此相较于颗粒较小的原始粒子,聚集体对于峰值的影响更大。Z-均直径和多分散指数值都对聚集体的存在表现敏感,因此可以很好地指示样本内是否存在聚集体。Z-均直径是光强加权流体力学直径的平均值,多分散指数PDI表征了颗粒粒径分布宽度。这两项参数均由系统根据动态光散射国际标准ISO22412计算得出。
关于动态光散射
纳米粒子的开发和配方需要对整个样本进行快速可靠的质量控制分析,而动态光散射提供了满足这一需求的解决方案。通过具有极高统计学意义的粒度分布图,DLS技术使用户能够快速地识别出聚集体或不合规格颗粒,而如果仅利用基于数量的粒度测量技术则可能无法做到。如今,商用DLS系统已经可以使用这一高端技术,为高级生物医药应用中的纳米粒子均匀性与聚集研究提供所需高灵敏度、高精确度和高分辨率分析。
作者:Stephen Ball ,为马尔文仪器纳米粒子与分子表征产品营销经理。他于英国萨里大学获得计算机辅助化学学位,期间作为研究化学师在瑞士豪尔根的陶氏化学公司进行了为期一年的产业实习。在加入马尔文仪器之前,他曾在Polymer Laboratories担任应用化学师,随后又在安捷伦科技担任光散射仪器产品经理一职。