ERBB2基因组有望成为PDAC治疗靶点
2019年5月2日,国际肿瘤学学术期刊《Carcinogenesis》在线发表了中国科学院上海营养与健康研究所-长征医院联合转化医学中心王跃祥研究组题为“Oncogenic ERBB2 Aberrations and KRAS Mutations Cooperate to Promote Pancreatic Ductal Adenocarcinoma Progression”的转化医学研究成果,该研究揭示了ERBB2的基因组变化是胰腺癌恶性进展的关键分子机制之一,并提供了靶向ERBB2抑制剂可用于治疗胰腺癌病人的实验依据。
约90%的胰腺癌为胰腺导管腺癌(Pancreatic Ductal Adenocarcinoma, PDAC),PDAC是医学界公认的“癌中之王”,其发现难、进展快、致死率高,病人早期没有明显症状,一旦发现多数已失去手术指征,临床上缺少有效的治疗手段,更缺乏有效的靶向治疗药物。成功的靶向治疗已使许多肿瘤(如肺癌、乳腺癌、胃肠道间质瘤等)患者的5年生存率大幅提高,PDAC中急需发现有药可用的治疗靶点,当前5年生存率小于6%。KRAS是PDAC重要的驱动基因,但绝大部分PDAC癌前病变,如胰腺上皮内瘤变已含有KRAS激活突变,提示从癌前病变进展为PDAC需要KRAS以外的分子机制。
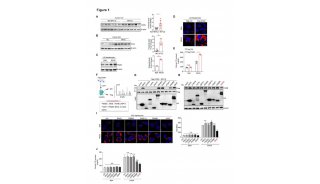
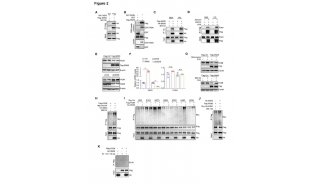
王跃祥系统分析了PDAC基因组测序数据,发现约8.5%的PDAC含有ERBB2的基因组变化,包括基因突变和基因扩增。ERBB2基因改变频率位于100个酪氨酸激酶基因的首位。有趣的是,含有ERBB2基因改变的PDAC同时含有KRAS突变,并且ERBB2基因改变与PDAC病人的不良预后相关。研究团队利用一些列体外、体内PDAC模型证明了PDAC中ERBB2基因改变具有致癌性,加速了PDAC恶性进展,降低了癌细胞对KRAS的依赖性。研究团队利用人源肿瘤异种移植小鼠模型,证明联合应用ERBB2抑制剂和KRAS抑制剂显著抑制人源PDAC的生长,为靶向ERBB2的药物用于胰腺癌病人的治疗提供了实验依据。
该项研究得到了海军军医大学附属上海长征医院邵成浩教授、复旦大学医学院卢媛教授和解放军总医院朱荔博士的支持和帮助。经费支持来自于国家自然科学基金委、科技部、上海市科委、中国科学院等,同时该研究得到上海营养与健康研究所公共技术平台、动物平台和长征医院转化医学平台的支持和帮助。
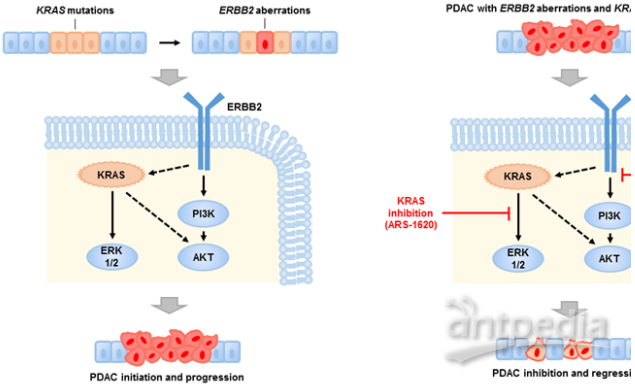
图左:ERBB2基因改变加速了KRAS驱动的PDAC恶性进展,右:联合应用 ERBB2抑制剂和KRAS抑制剂显著抑制PDAC的生长
-
技术原理
-
焦点事件