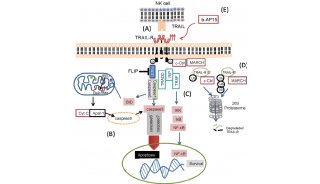
ZBP1 蛋白在细胞坏死以及炎症反应中的调控机制
长期以来,我们对于具有左手双螺旋结构的核酸分子(即 Z-DNA 和 Z-RNA)的生物学功能知之甚少。Z-DNA 结合蛋白 1(ZBP1,也称为 DAI 或 DLM -1)是一种能够结合上述核酸分子的蛋白质,它包含两个 Zα 域,分别能够结合 Z-DNA 和 Z-RNA。
此前研究表明,ZBP1 通过感测病毒核酸介导宿主防御特定病毒感染。此外,小鼠水平的研究结果表明,RIPK1 缺乏会触发由 ZNP1 介导的细胞坏死以及炎症反应。然而,在没有病毒感染的情况下,ZBP1 激活的机制仍然不够清楚。
近日,Nature 杂志发表了一篇题为《Z-nucleic-acid sensing triggers ZBP1 -dependent necroptosis and inflammation》的文章中,来自德国科隆大学的研究者们发现 ZBP1 通过其 Zα 结构域识别内源性的 Z-RNA 分子,进而促进 RIPK3 介导的细胞坏死以及炎症反应的发生1。
这一研究为揭示细胞坏死以及炎症反应过程中的信号转导提供了新的证据。

图片来源:Nature
背景介绍
Z-DNA 结合蛋白 1(ZBP1),最初于 1999 年被发现,当时研究者们在研究肿瘤及其相关细胞和组织之间相互作用时发现了一个新基因,该基因在肿瘤基质和活化的巨噬细胞中表达量被上调。之后的序列分析表明其 N 末端存在一个能够与 Z-DNA 结合的结构域,从而被归类为 Z-DNA 结合蛋白家族 2。
后续的研究表明,ZBP1 主要表达于免疫细胞中,并且可以受 IFN 诱导而上调,此外,研究表明 ZBP -1 能够与细胞,病毒等来源的 RNA(Z-RNA)以及病毒来源的 Z-DNA 结合,因此,ZBP1 在宿主防御肿瘤和病毒感染中的可能发挥着重要作用 3 -4。
结构与功能方面的研究表明,ZBP -1 蛋白具有能够结合左旋核酸(Z-形式)的结构域和用于同源蛋白质相互作用的 RHIM 结构域。近年来,很多研究已经表明 ZBP1 是识别病毒感染的先天传感器,并且能够抑制细胞死亡,促进炎症小体激活等信号通路 5。另一方面,ZBP1 在发育过程中也起着重要的作用,在不受 RHIM 依赖的相互作用时会触发胚胎期致死性。
虽然 ZBP -1 长期以来被认为是识别内外源 Z 型核酸分子的天然免疫感受器,但针对 ZBP -1 在细胞坏死以及炎症反应中的具体作用机制目前仍然不够清楚。
针对这一问题,来自德国科隆大学遗传学研究所的科学家们通过构建不同的小鼠突变模型,揭示了 ZBP -1 对于不同类型炎症发生的作用,并且深入研究了其介导信号传递的内在机制。
研究内容
为了研究 ZBP1 感知 Z 型核酸(Z-NAs)的能力以及其生物学意义,我们构建了 Zα1 和 Zα2 结构域缺失的 ZBP1 蛋白的转基因小鼠(Zbp1 ΔZα/ΔZα 小鼠)。此外,作者还构建了 Zα1 和 Zα2 结构域突变的 Zbp1 转基因小鼠(Zbp1 mZα1 -2 /mZα1 -2)或单独 Zα2 结构域突变的转基因小鼠(Zbp1 mZα2 /mZα2)。对于突变的设计原理,是通过特定突变替代了与 Z-NA 相互作用必须的关键氨基酸(Zα1 结构域中的 N46D、Y50A 以及 Zα2 结构域中的 N122D 、Y126A)。
为了研究 ZBP1 蛋白中的 RHIM1 结构域的作用(以前已证明它可以介导 ZBP1 信号),我们又构建了 Zbp1 mR1 / mR1 转基因小鼠,通过四个氨基酸的替代突变,破坏了其核心 RHIM 序列(I192A / Q193A / I194A / G195A)。这些突变 ZBP1 小鼠品系能够正常繁殖并且没有显示任何明显的异常。WB 分析结果也表明这些蛋白质均能够正常表达。
另一方面,大多数 Zbp1 ΔZα/ΔZα和 Zbp1 mZα2 /mZα2 小鼠在感染后 5 天在脾脏和肝脏中显示出较低的病毒滴度,并且在 14 天后唾液腺中没有可检测到的活病毒,这表明它们对病毒的控制能力优于 Zbp1 -/-和 Mlk1 -/-小鼠。因此,依赖 Zα的 ZBP1 激活信号对于在感染早期限制病毒的繁殖十分重要。但是,后续阶段直到完全清除病毒则并不需要 Zα结构域的存在。
为了研究在没有病毒感染的情况下 ZBP1 是否需要依赖 Zα与内源性配体分子识别并发生感应,作者将 Zbp1 ΔZα/ΔZα和 Zbp1 mZα2 /mZα2 与 RIPK1 E-KO 小鼠杂交,并进行了后续分析(下图)。

众所周知,RIPK1 E-KO 小鼠会自发地出现皮肤角质细胞坏死,从而产生炎症性皮肤病变,该小鼠通常仅能够存活 8 周左右。相比之下,RIPK1 E-KO Zbp1 ΔZα/ΔZα和 RIPK1 E-KO Zbp1 mZα2 /mZα2 小鼠在该年龄段仍保持健康。此外,RIPK1 E-KO Zbp1 mR1 / mR1 小鼠也没有发生皮肤炎症,从而暗示了 RHIM1 在此过程中的重要作用。
但是,大多数 RIPK1 E-KO Zbp1 ΔZα/ΔZα和 RIPK1 E-KO Zbp1 mZα2 /mZα2 小鼠在 18 至 42 周龄之间出现了轻度皮肤损伤。相比之下,只有 15% 的 RIPK1 E-KO Zbp1 mR1 / mR1 小鼠在 40 周龄时表现出非常轻微的皮肤损伤。
因此,尽管内源性配体的 Zα依赖性感应触发了幼年 RIPK1 E-KO 小鼠的 ZBP1 介导的角质形成细胞坏死和皮肤炎症,但 ZBP1 还表现出其它与 Zα结构域无关的功能,从而促进老年小鼠皮肤损伤的发展,这与病毒感染过程中的发现一致。
为了研究 Ripk1 mR / mR 小鼠的胚胎期致死性是否需要 Zα依赖的内源配体传感和 RHIM1 依赖的信号传导,作者将它们与 Zbp1 ΔZα/ΔZα,Zbp1 mZα2 /mZα2 和 Zbp1 mR1 / mR1 小鼠杂交。
结果表明,Ripk1 mR / mR Zbp1 ΔZα/ΔZα,Ripk1 mR / mR Zbp1 mZα2 /mZα2 和 Ripk1 mR / mR Zbp1 mR1 / mR1 小鼠能够存活,而且没有出现表皮增生症状。这些小鼠成年之后,直到至少一岁时没有表现出明显的病理迹象。
IFNγ刺激的肺成纤维细胞和角质形成细胞的免疫印迹分析证实,突变的 ZBP1 蛋白与野生型 ZBP1 的表达相似,但截短的 ZBP1(ΔZα)除外,后者的水平较低(表明其稳定性可能降低)。用 IFNγ或 IFNα刺激能够诱导 Ripk1 mR / mR(而非野生型)小鼠的小鼠胚胎成纤维细胞(MEF)出现 ZBP1 介导的坏死现象,这一效应依赖于完整的 Zα域和 RHIM1 结构域。
总之,上述结果表明,ZBP1 通过 Zα结构域对内源性配体的感知能够在 Ripk1 mR / mR 小鼠中诱导 RHIM1 介导的胚胎期致死以及 IFN 诱导的 Ripk1 mR / mR 细胞坏死的发生。
为了研究在 RIPK1 完整的情况下内源性 Zα域配体的感应是否仍然会引发坏死和炎症的发生,作者评估了 Zα依赖性 ZBP1 激活在缺乏 FADD 的小鼠中,特别是在肠上皮细胞(IEC)中的效应(下图)。对此,作者采用了肠上皮细胞 FADD 蛋白特异性缺失的小鼠模型(FADD IEC-KO 小鼠)并且与 ZBP -1 系列突变小鼠进行杂交。FADD IEC-KO 小鼠由于 IEC 的 RIPK3 依赖性坏死而自发地产生结肠炎。
结果表明,FADD IEC-KO Zbp1 中两个 Zα结构域的缺失或突变(FADD IEC-KO ΔZα/ΔZα和 FADD IEC-KO Zbp1 mZα1 -2 /mZα1 -2)抑制了 FADD IEC-KO 小鼠结肠炎的发展,免疫细胞浸润大大减少,没有溃疡形成以及结肠组织总体正常。这些结果表明,FADD–caspase -8 信号的抑制使细胞对依赖 Zα 的 ZBP1 介导的坏死病敏感。
为了在细胞中对此进行评估,作者用 IFNγ刺激了野生型或 ZBP1 缺陷型 MEF 24 小时,然后用半胱天冬酶抑制剂 emricasan(IDN -6556)处理,发现半胱天冬酶抑制作用导致受到 IFNγ预处理的细胞死亡。但是,这一效应不受 ZBP1 缺乏的影响。由于细胞自身分泌的 TNF 信号可能导致 IFNγ诱导的细胞死亡,作者使用了 TNF 抑制剂 etanercept 并且重复了该实验。
结果表明,抑制自分泌 TNF 信号阻止了用 IFNγ和 Emricasan 处理的 ZBP1 缺陷细胞(而非野生型细胞)的死亡。IFNγ,Emricasan 和 etanercept 的组合诱导的细胞死亡与 RIPK3 和 MLKL 的磷酸化相关,并且可以通过 RIPK3 或 MLKL 的缺失来阻断。
Zbp1 ΔZα/ΔZα,Zbp1 mZα1 -2 /mZα1 -2,Zbp1 mZα2 /mZα2 和 Zbp1 mR1 / mR1 小鼠的肺成纤维细胞能够免于在 IFNγ,Emricasan 和 etanercept 的组合诱导下,因 RIPK3 和 MLKL 的激活介导的细胞死亡的发生,这表明当抑制半胱氨酸蛋白酶时,依赖于 Zα的内源性配体感应会触发 ZBP1 -RIPK3 -MLKL 介导的坏死的发生。
此外,当 caspase -8 被抑制时,在没有 IFN 刺激的情况下 ZBP1 表达足以导致细胞坏死的发生,而且这一过程依赖于 ZBP -1 蛋白的 Zα结构域。这些发现表明 caspase -8 可能通过降解 ZBP1–RIPK3 复合物的成分来负向调控 ZBP1 介导的 RIPK3 的激活。
作者认为,RHIM 介导的 RIPK1 的招募可以通过促进 FADD 与 caspase -8 的相互作用来抑制 ZBP1 -RIPK3 的激活,并研究了在 Emricasan 存在的情况下 RIPK1 是否参与了 ZBP1 -RIPK3 的募集。
免疫共沉淀结果表明,RIPK1 与 RIPK3 在仅在 emricasan 存在的情况下在过表达 ZBP1 的细胞中发生聚集。此外,ZBP1 在缺失 RHIM 结构域时与 RIPK3 不发生相互作用。这表明 Z-NA 感应促进了 ZBP1 与 RIPK3 的结合,且这一过程需要 RHIM 的参与。
总体而言,上述结果表明,当 caspase -8 活性被抑制时,内源性配体与 ZBP1 通过 Zα结构域的识别会触发 RIPK3 -MLKL 介导的细胞坏死,这一机制对 FADD IEC-KO 小鼠结肠炎的发展至关重要。

先前的研究表明 ZBP1 通过其 Zα域可以感知病毒,但也可以感知内源性 RNA。为了评估 ZBP1 是否通过其 Zα域结合细胞双链(ds)RNA,作者使用 dsRNA 特异性 J2 抗体从表达野生型 ZBP1 或 ZBP1(mZa1 -2)的永生化 MEF 中进行 dsRNA 免疫共沉淀(下图)。
结果表明,野生型 ZBP1 与 dsRNA 能够发生共同免疫沉淀,而 ZBP1(mZa1 -2)则没有上述活性,这一结果表明 ZBP1 能够通过 Zα 域与 dsRNA 结合。因此,dsRNA 可能是 ZBP -1 内源性配体。

先前研究已经表明在细胞核中转录病毒基因组会触发 ZBP1 介导的细胞死亡。为了评估内源性 Z-NA 的传感是否同样会触发细胞核中 ZBP1 的活化,作者用干扰素预刺激野生型 MEF 24 小时,以诱导 ZBP1 的表达,然后用细霉素 B(LMB)抑制核酸分子向细胞核外转运的过程(下图)。
结果表明, LMB 处理用 IFNγ或 IFNα预先刺激的 MEF 会导致 ZBP1 和 RIPK3 依赖性的细胞死亡的发生,这一效应能够因 MLKL 缺失而得到一定程度的抑制。此外,使用另外一种核转运抑制剂 29 KPT330 处理 IFNγ预刺激的细胞也可诱导野生型细胞死亡,但 Zbp1 -/-的肺成纤维细胞则没有明显死亡。
WB 分析表明,大多数 ZBP1,RIPK3 和 MLKL 蛋白存在于胞质组分中。在用 LMB 处理后,在 IFNγ刺激的细胞核中仅检测到少量这些蛋白质,并且这些数量并未进一步增加,这表明阻断核输出不会诱导 ZBP1,RIPK3 和 MLKL 在细胞核中的积累。
然而,IFNγ和 LMB 处理的细胞核中检测到 RIPK3 的强磷酸化,而 MLKL 的磷酸化较弱,这表明 ZBP1 激活了核中的 RIPK3。ZBP1 激活需要 Zα依赖的内源配体的信号激活,这一事实表明,在 Zbp1 ΔZα/ΔZα,Zbp1 mZα2 /mZα2,Zbp1 mZα1 -2 /mZα1 -2 和 Zbp1 mR1 / mR1 中, RIPK3 和 MLKL 的磷酸化受到抑制,因而 IFNγ和 LMB 处理引起的细胞死亡也得到了抑制。
综上所述,这些结果表明 ZBP1 感应内源性 Z-NA 并激活细胞核中的 RIPK3,从而诱导细胞死亡的发生。尽管 LMB 处理触发 ZBP1 激活的确切机制尚不清楚,但阻断核转运可能导致 Zα配体在核内积累。
另外,抑制核输出可能保护 ZBP1-RIPK3 复合物免受细胞质中 RIPK1 -FADD-CASP8 信号的负调节作用。

研究总结
尽管很久以来我们已经知道了 Z-DNA 和 Z-RNA 的存在,但它们的生理作用仍然知之甚少。这在很大程度上是因为缺少可靠的工具,无法对活细胞和生物体中的 Z-NA 进行检测和功能分析。研究感测 Z-NA 的 Zα 结构域的功能是目前研究 Z-NA 的功能的唯一方法。
在这一研究中,作者提供了实验证据,支持通过 ZBP1 的 Zα 域感应内源性 Z-NA 激活 ZBP1 介导的细胞死亡和炎症的观念。目前尚不清楚由 ZBP1 感测到的内源性 Z-NA 的确切性质,但作者的结果表明, dsRNA 是触发 ZBP1 激活的最可能的配体。
此外,作者认为 ZBP1 的 Zα结构域能够组成性地结合细胞中的 Z-RNA 分子,而 RIPK3 激活通常受到 RIPK1 -FADD 依赖的 caspase -8 募集的抑制,后者往往能够裂解并抑制 RIPK1 和 RIPK3 的活性。因此,在 RIPK1 和 CASP8 基因突变的患者中,Zα 介导的 ZBP1 信号传导的活化可能有助于自身炎症性疾病的发生,并且导致这些患者对抗 TNF 治疗无反应。
总体而言,这一研究表明,内源性 Z-NAs 的 Zα依赖性信号可触发 ZBP1 介导的细胞死亡和炎症,这可能与诸多炎症性疾病的发病机制有关。