Cell:揭示一种引导细胞垃圾进行自噬的新机制
细胞通常很擅长识别不会正常发挥功能的组分。它们不断地进行自我清理---从它们自己的东西中挑出不再有用的东西,比如受损的或多余的细胞器,不能折叠的蛋白。
但是,当细胞无法识别垃圾时会发生什么?缺陷性的细胞物质的堆积参与亨廷顿舞蹈病、阿尔茨海默病、帕金森病和葛雷克氏症(ALS)等疾病,在这些疾病中,这些垃圾阻止神经元传递信号。
图片来自Cell, 2019, doi:10.1016/j.cell.2019.02.009。
如今,在一项新的研究中,来自美国圣路易斯华盛顿大学的研究人员发现了一种之前未知的对细胞垃圾清理至关重要的活细胞结构特征。相关研究结果于2019年4月4日在线发表在Cell期刊上,论文标题为“ATG8-Binding UIM Proteins Define a New Class of Autophagy Adaptors and Receptors”。论文通讯作者为圣路易斯华盛顿大学生物学教授Richard Vierstra博士。论文第一作者为圣路易斯华盛顿大学的Richard Marshall。
用于清理垃圾的新受体
细胞清理垃圾的一个主要方法是通过自噬。在这个过程中,细胞将不需要的物质(即垃圾)吞噬到囊泡中,这些囊泡随后沉积在称为液泡或溶酶体的垃圾箱中。在那里,这种垃圾受到降解,它的构成单元(building block)得到重复使用。
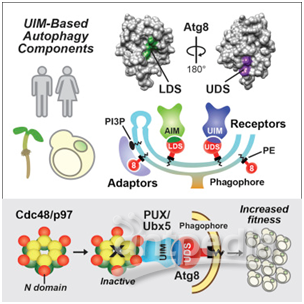
这种回收过程的关键是识别这种垃圾并将它结合到蛋白ATG8上的受体,其中这种蛋白排列在吞噬囊泡上。在此之前,所有这些受体都被认为是相关的,并通过相同的机制与ATG8结合。
Marshall说,“ATG8上存在着人人都已知道的结合位点,以及它如何与自噬受体相互作用。但是,我们发现如果将这种分子完全旋转180度,那么它的相反的一边上存在的新位点识别一长串额外的运货受体(cargo receptor)。”
他补充道,“植物、酵母和人类中的一大堆蛋白都在使用这种新的结合位点及其同源受体来与ATG8相互作用。”
为了结合到这个特定的对接平台上,这些新发现的运货受体使用一种之前与自噬无关的称为泛素相互作用基序(ubiquitin-interacting motif, UIM)的结合位点。
Marshall说,“这是一种完全不同的相互作用机制。这一发现代表了可能控制自噬的潜在ATG8相互作用蛋白的数量激增,所有的这些蛋白都在使用这种新的位点。”
对人类健康的影响
了解这些新的运货受体如何发挥作用可能揭示出与人类疾病相关的新型预防或治疗靶标。
Marshall和Vierstra还描述了这些新的运货受体中的一种特定受体,它有助于清除一种称为CDC48或p97的关键蛋白。
当有缺陷的蛋白堆积时,蛋白毒性应激(proteotoxic stress)就会发生,细胞就会无法清理它们。CDC48是这个过程的一部分,但是它也能够让事情变得更糟糕。缺陷性的蛋白和CDC48倾向于开始形成缠结的蛋白聚集物,就像阿尔茨海默病和帕金森病中发现的那样。
Vierstra说,“CDC48是一种解折叠酶(unfoldase),这意味着它抓住蛋白,让它们解折叠,并将它们运送给可降解它们的蛋白酶。让你的蛋白补充保持正常和发挥功能需要CDC48。如果它不起作用,那么你就会遇到各种各样的问题,包括神经元堵塞。”
Vierstra指出,CDC48作为六聚体存在---一种具有六个重复单元的分子复合物,而且即便这种复合物中存在一个不好的拷贝就会让这整个复合物遭受自噬。
Vierstra说,“正如人们所说,一个烂苹果坏了一桶酒。但是在一些神经系统疾病中,你仅需要一个有缺陷的CDC48,只要你无法清理由此带来的混乱局面,那么事情就会发生差错,从而产生不良后果。”







