Nature子刊 造血干细胞在三维两性离子水凝胶环境的扩增
基于造血干细胞体外扩增和基因修饰的治疗技术在临床上的应用潜力巨大,如何解决干细胞离体后的分化并最大程度的保持其再生能力是制约这一技术发展的最大挑战。脐带血是造血干细胞的主要来源,但稀少的数目制约了它的进一步临床应用,科学家们在近年研发出各种临床相关的造血干细胞体外扩增办法:包括Notch-1 配体体外扩增法 (Nohla Therapeutics公司)以及SR1和UM家族等小分子添加物体外扩增法 (Magenta Therapeutics公司 和 ExcellThera公司) 。尽管这些方法在在干细胞数量上都获得了有效扩增,但扩增过程中都伴随着极其明显地分化,再生能力和原代干细胞相比会显著下降。突出的表现是具有长期移植能力的造血干细胞经体外扩增后丧失了在体内长期植入的能力。这一弊端极大地限制了干细胞领域的科学发现和临床应用。
2019年10月7日,美国华盛顿大学的Shaoyi Jiang教授团队和Fred Hutchinson肿瘤研究中心的Colleen Delaney教授团队(第一作者为白涛和李建强博士)在Nature Medicine杂志上发表了文章Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel,创造性地发明了一种两性离子材料构成的三维水凝胶包裹造血干细胞的体外扩增方法,既能实现长期稳定大量的体外扩增,又能保持原代造血干细胞的再生能力,尤其是对具有长期移植功能的造血干细胞的扩增潜能,对干细胞及基因治疗领域的进一步发展具有突破性意义。

研究人员设计开发了一种两性离子材料构成的三维水凝胶造血干细胞培养方式。此类两性离子新型生物材料能极大的模拟出造血干细胞在骨髓中的生长环境。此类两性离子水凝胶具有跟骨髓基质类似的机械强度,超高的亲水性(不同于细胞培养皿的超疏水性),超高的生物相容性以及三维培养所特有的超高细胞培养密度。在体外长达24天的培养过程中,对具有长期移植功能的造血干细胞进行了高达73倍的扩增并未发现明显的细胞分化。使用该方法扩增的造血干细胞,在老鼠体内可长期移植并且可以成功进行二次移植。尤其重要的是,此种造血干细胞体外扩增的办法对脐带血造血干细胞和成人骨髓中获取的造血干细胞具有类似的体外扩增效应。
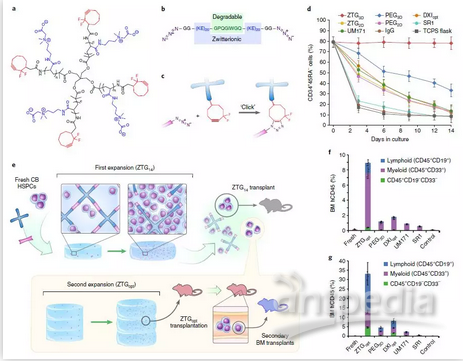
a-c, 双离子水凝胶合成示意图;d, CD34+CD45RA-的原始造血干细胞在不同培养体系中所占的比例;e, 水凝胶设计和实验流程图;f-g, NSG免疫缺陷鼠接种不同培养体系的造血干细胞后,骨髓中植入能力的比较。
在该技术研发过程中,李建强博士及其合作者对该扩增平台的基础原理也产生了极大的兴趣。为了搞清楚两性离子水凝胶对造血干细胞体外无规则分化的抑制原理,就要先搞清楚为什么能在体内长期自我更新长达几十年的造血干细胞在体外培养的几天内就会显著分化并丧失长期移植能力。在经过一段时间研究后,李建强博士团队发现超疏水性的塑料细胞培养皿是“罪魁祸首”。在实验室细胞培养过程中,聚苯乙烯制成的塑料细胞培养皿由于大量的工业化生产得到了广泛应用。但是在自然界中,没有一种生物体内会存在哪怕一点的塑料!这是因为塑料的高疏水性会造成极其严重的蛋白非特异性吸附,而这种非特异性吸附会造成一连串的负面生物反应,统称排异反应。例如注射到血液中的疏水纳米粒子会在极短时间内造成血液蛋白的聚集包裹并诱导有机体产生相应抗体。再比如移植到体内的疏水生物器械会在短时间内被胶原纤维囊包裹并与身体其他部分隔离开。在对细胞的体外培养中,同样的问题再一次到来。
在本篇工作的研究过程中,李建强博士及其合作者发现在体外细胞培养皿的疏水培养过程中,造血干细胞内会在极短时间内产生大量活性氧类 (ROS)。此类物质是生物有氧代谢过程中的一种副产品,包括氧离子、过氧化物和含氧自由基等。这类氧化物与细胞内所有重要功能相关蛋白质进行非特异性氧化。而造血干细胞在对p16, p38,mTOR和β-catenin等一系列信号相关蛋白遭受氧化的一个直接后果就是细胞分化和衰老死亡。而与目前疏水塑料培养皿构成显著差别的就是两性离子材料的超亲水性。该材料单元同时负载正电荷和负电荷,具有和细胞膜主要结构物质卵磷脂相似的化学结构,对外体现电中性以及强烈的吸水性和亲水性,对蛋白的非特异性吸附和激活有极其显著的抑制作用。在本篇工作中,李建强博士及其合作者发现在此类材料内生长的造血干细胞内,活性氧类物质的产出被得到了极大的抑制。既然干细胞分化衰老的源头得到了显著抑制,那么造血干细胞的体外分化得到抑制也就不足为奇了!
此类对具有长期移植能力的造血干细胞进行体外扩增的技术目前在世界范围内尙属首次报道。可以预见此类技术的工业转化能够极大的促进造血干细胞相关的实验室研究和临床转化。此技术与基因治疗的相结合会创造出无数的想象空间。为尽快促进该研究成果在干细胞及基因治疗领域的临床转化,李建强博士积极回国创业,创建了河北森朗生物科技有限公司,目前该公司已经形成100多人的科研团队,在干细胞及CAR-T细胞治疗领域成果卓越。
原文链接:
https://doi.org/10.1038/s41591-019-0601-5