一种无酚/无氯仿组织研磨从热带木本植物中提...(二)
三、结果
1、无苯酚/氯仿的CTAB / PVP / SDS-based RNA提取
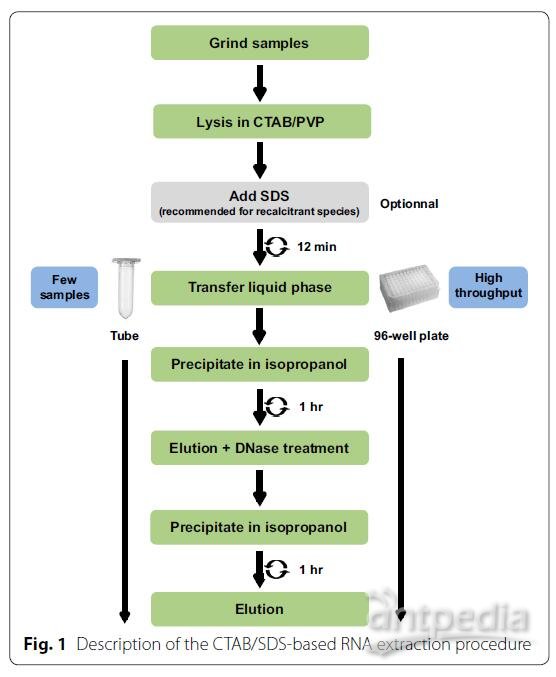
在下面介绍的第一批实验中,我们开发并测试了一种使用40-60 mg牛油果、夏威夷果和芒果成熟叶片的冷冻叶组织提取RNA的方法。在发表的文献中,用于困难树种开发的大多数RNA提取方法,通过使用CTAB / PVP裂解缓冲液中调高盐(NaCl)浓度,可以提高RNA产量和质量。因此,我们使用该缓冲液裂解我们的样品。大多数提取方法都使用此缓冲液来提取RNA,同时联合使用苯酚/氯仿法从蛋白质中分离出核酸。但是,我们不使用苯酚和氯仿,因为它们具有毒性,同时它们不可能在96孔板中实现高通量。因此,我们决定通过加入一定量的异丙醇,并在裂解步骤后离心样品,来得到RNA沉淀(图1)。在这个阶段,蛋白质和不需要的化合物(如多糖和多酚)会溶解在上清液中,并且很容易可以除去。用乙醇洗涤沉淀后,将核酸重悬,并进行DNase处理,然后在异丙醇中进行另一轮沉淀并洗脱以回收RNA。图2中的质量控制显示RNA未被降解,并且260/280的比率高于1.79,表明提取过程中蛋白质被去除。260/230的比例在1.2至1.56之间,具体取决于物种,这表明残留了一些多糖。
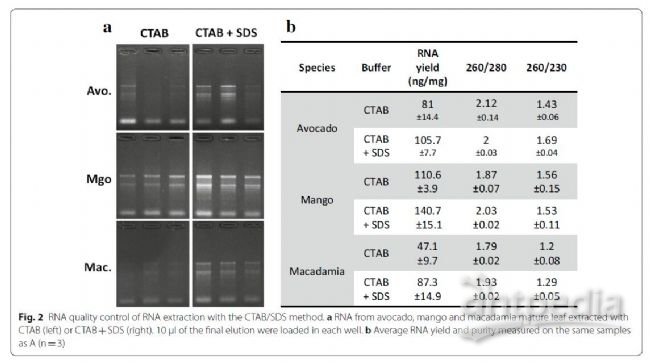
为了改进方法,在60°培养步骤后将1%SDS添加到裂解缓冲液中。SDS是一种清洁剂,可帮助消化细胞膜并在此步骤中释放更多核酸。SDS还具有破坏核酸/蛋白质相互作用,并促进CTAB
/核酸复合物溶解的特性,从而改善了核酸的沉淀并提高了产量。用SDS本身提取的样品获得的RNA产量比CTAB /
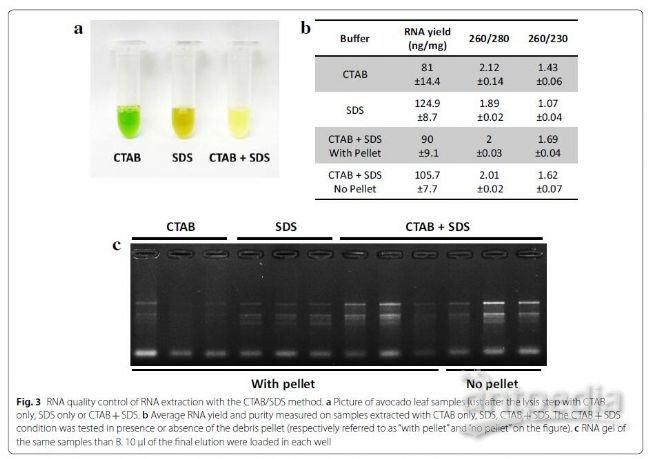
PVP缓冲液更好。但是,260/230的比例非常低(1.07),无法防止样品氧化(图3a)。结合CTAB和SDS方法来改善产率(图2、3)。这在夏威夷果中尤为明显,其RNA产量几乎翻了一番。如通过裂解步骤后的样品颜色观察(图
3a),CTAB /
PVP和SDS的组合也抑制了样品氧化和叶绿素变性,这是SDS的已知作用。CTAB和SDS之间的相互作用形成微胶束,产生可见的混浊沉淀,导致离心后在缓冲液和空气之间界面处形成半固体白色层。
因没有CTAB或样品管中有植物组织,SDS对产量的影响并未降低(图3)。这表明在该方法中,SDS对产量的影响可能是由于其从核酸中分离蛋白质的能力,而不是其组织裂解活性或其溶解CTAB /核酸复合物的性质。此外,添加SDS还可略微提高牛油果和夏威夷果的260/230比例,这表明CTAB和SDS的组合可在最终洗脱过程中稍微降低多糖含量(图3)。
2、从不同组织类型中提取RNA
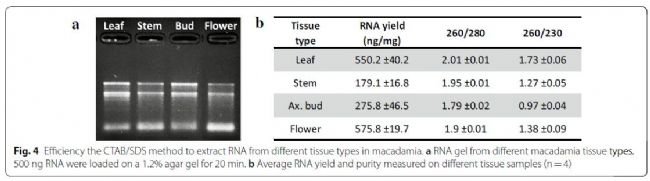
然后,我们测试了该方法对于不同类型的组织是否有效。为了测试这一点,我们使用15–30 mg的四种不同夏威夷果组织(叶、茎、花、腋芽)进行了相同的步骤。质量/数量控制表明,该方法对夏威夷果的这四种组织类型均有效(图4)。还对根组织进行了测试,但结果不一致,不能认为是成功的(数据不包括在内)。从茎和休眠腋芽中提取的RNA量要少于从叶和花中提取的RNA,这可能是由于这种组织中所含的活细胞数量较少。对于所有组织,260/280均高于1.79,表明蛋白质已从样品中有效去除。260/230比值较低,这可能是由于这些组织类型中包含大量次要化合物。
3、使用96深孔板提取RNA
我们希望能开发一种可以同时提取大批量样本的方法。为了实现这一目标,我们注意到该方法的一个特点:在裂解步骤之后,该方法不需要在通风橱中进行移液,不像使用苯酚和氯仿的方法一样。因此,我们在2 ml 96深孔板上使用与样品管进行相同的步骤。与样品管结果相比,使用深孔板提取的结果令人满意,可以在图5中所示的质量控制结果看出。且使用96深孔板方法,仅需一天即可提取96个样品(不包括研磨时间),而使用96通道的移液器(PLATEMASTER,Gilson)可以使花费的时间更短。
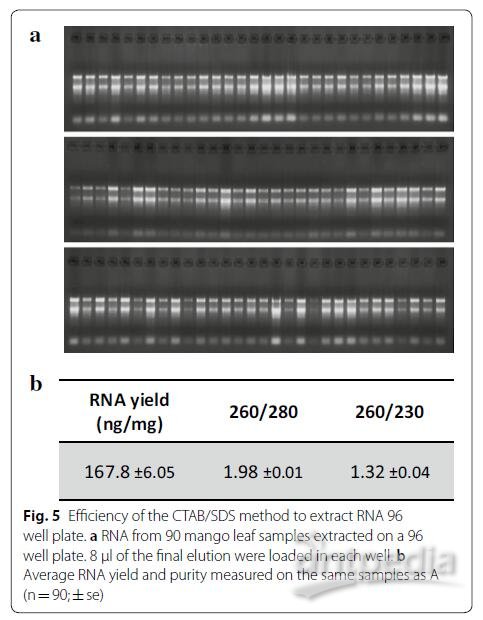
4、实时定量PCR和RNA-Seq读取质量控制
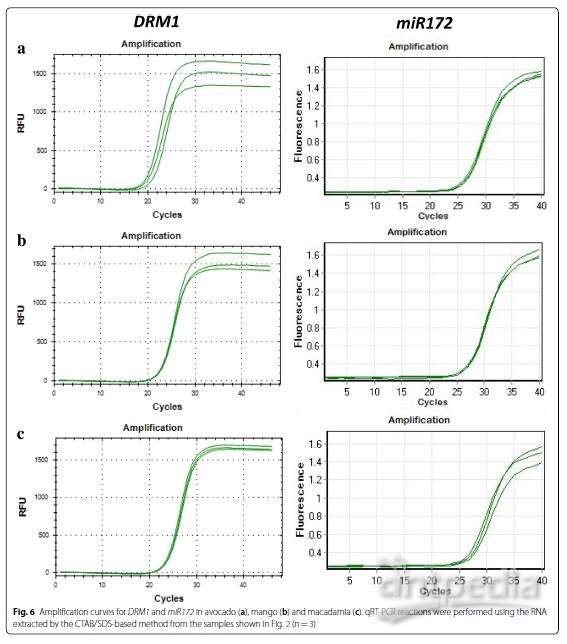
为了证明提取方法所产生的RNA质量足够好,我们使用RNA进行实时定量PCR和RNA测序。用DORMANCY1(DRM1)和miR172在三种树种中获得的扩增(图 6)和解链曲线(附加文件1:图S1)证明,RNA可成功用于定量RT-PCR(图 6)。这些结果表明,即使在某些样品中260/230比值不是最佳的,用这种方法分离的RNA的质量也足以进行基因和miRNA定量分析。
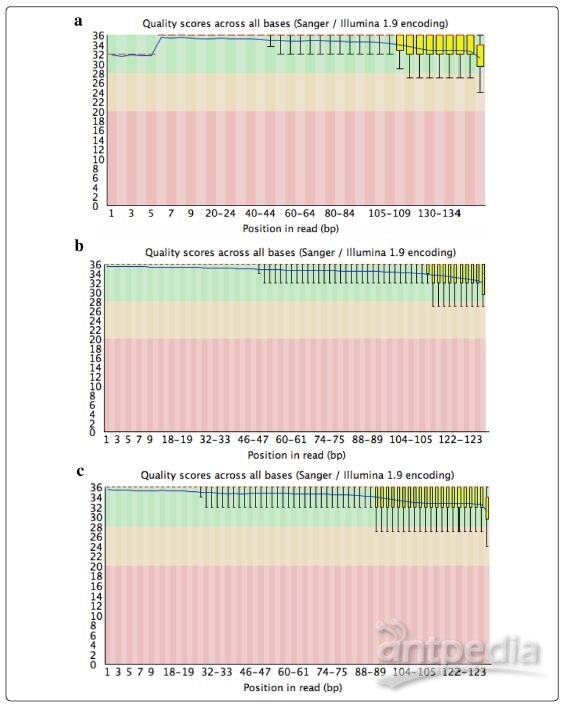
为了进一步证明我们的RNA提取方法的适用性,我们使用该方法为牛油果、夏威夷果和芒果树中的每一种样品制备标准化的RNA-Seq库,并使用Illumina测序技术对其进行了测序。使用此方法获得的基因库质量控制数据表明,使用本文所述方法提取的RNA质量很好,完全满足RNA提取实验要求(图 7和附加文件2:图S2)。在使用Trimmomatic进行标准修整和质量控制后,使用FastQC版本0.11.5(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)进行质量评估,数据表明质量良好(图7),且具有统一的高质量碱基调用,以读取正向(图 7)和反向(附加文件2:图S2)序列的末尾。这说明大多数序列读数均为高质量,这为后续的遗传分析提供了保障。

5、序列映射检测
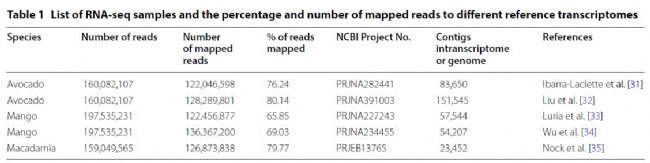
为了验证我们的RNA测序,我们使用HISAT v.2(默认设置)将修饰后的序列映射到已发布的转录组和基因组序列中(如表1)。我们牛油果样品中有76%和80%的读段映射到Persea americana var'drymifolia' and cv. ‘ Lisa’转录组序列集中。我们芒果样品的读段中有66%和69%映射到印度芒果(Mangifera indica L. cv. 'Shelly' and 'Zill'转录组序列集中。我们夏威夷果样品中有79%的读断映射到夏威夷果Madamadia integrifolia cv. 741 ‘Mauka’基因组序列集草案中。这种质量控制进一步支持了用我们的方法提取的RNA的质量足以进行各种转录组学研究。
6、无苯酚/氯仿的CTAB / PVP / SDS-based DNA提取
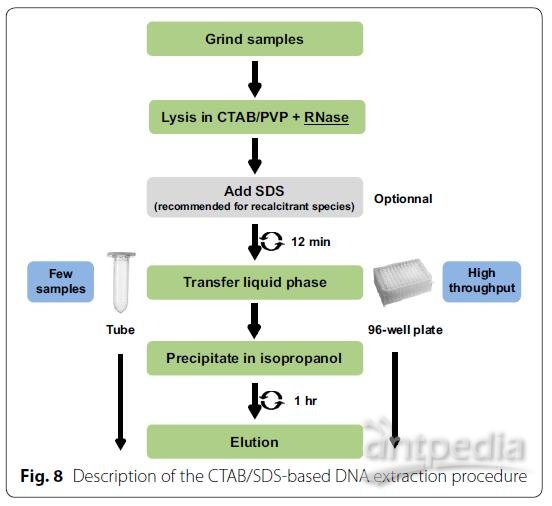
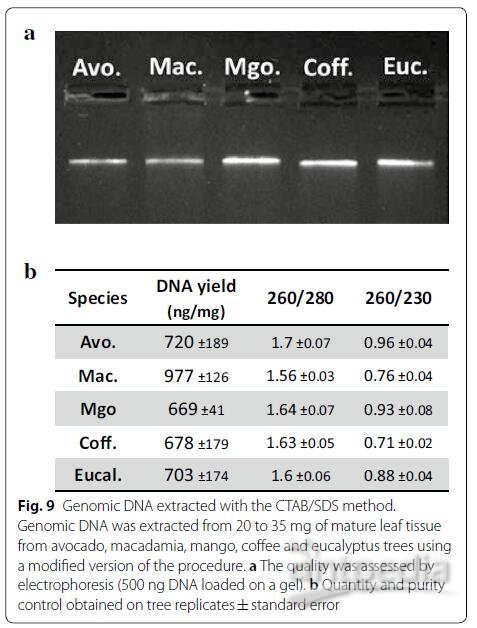
对树木进行DNA提取方法时通常遇到的问题与RNA提取方法相同。因此,我们决定测试这种RNA提取方法是否可以转换为基因组DNA提取方法。为实现此目的,我们通过用RNase代替CTAB缓冲液中的DTT来修改方法,以在裂解步骤中去除RNA。对于RNA提取,在裂解步骤结束时添加1%的SDS,并执行一次沉淀/洗涤/洗脱循环以回收纯化的DNA(图8)。我们的样品还包括来自室外种植的咖啡树和桉树的成熟叶片样品,这两个物种在DNA提取方面众所周知是有挑战性的。图9所示的是质量和数量控制结果,图示表明,所获得的提取量令人满意,并且提取的DNA没有降解。因此证明,该方法可以转化为困难的热带和亚热带物种样品的DNA提取方法。
四、结论
在过去的十年中,转录组测序的价格已大大降低,促使研究人员设计更大规模的实验。但是,用于木质热带物种的核酸提取的化学药品的毒性和不实用性,是这些样品进行大规模实验主要面临的问题。我们在此描述的方法可以降低这些问题的影响,并将促使人们进行更多大规模的实验,以便于研究在分子生物学中被认为是困难的物种。


-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
焦点事件























