Molecular Cell封面文章:内质网如何调控自噬小体形成
来自中科院生物物理研究所的研究人员发表了题为“The ER-localized transmembrane protein EPG-3/VMP1 regulates SERCA activity to control ER-isolation membrane contacts for autophagosome formation”的文章,阐述了课题组前期研究发现的多细胞生物特有的自噬蛋白EPG-3/VMP1参与内质网(ER)调控自噬小体形成过程的机制。
这一研究成果公布在9月21日的Molecular Cell杂志封面上,文章的通讯作者为生物物理所的张宏研究员,张宏课题组副研究员赵燕为本文的第一作者。
自噬(autophagy)是生物体内高度保守的降解途径。细胞通过形成双层膜结构的自噬小体,包裹部分细胞质或受损细胞器,并将之运送到溶酶体进行降解,这一过程被称为自噬。自噬是细胞清除自身垃圾,维持稳态平衡的重要生命过程。人们先前对于自噬分子机制的认识主要来源于单细胞酵母,而多细胞生物体内的自噬过程更为复杂,存在多个酵母中没有的步骤。例如,自噬小体的形成过程中,隔离膜(IM)与ER存在着广泛的相互作用,但是这种相互作用的形成、维持以及解离的分子机制尚不清楚。
张宏研究组此前曾利用线虫进行遗传筛选发现了多个多细胞生物特有的自噬基因,其中包括EPG-3(哺乳动物中同源蛋白为VMP1)。
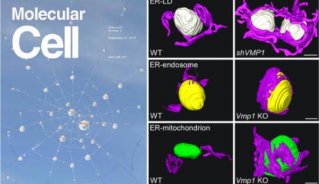
在最新研究中,研究人员发现EPG-3/VMP1定位于内质网上,调控ER-IM的相互作用。VMP1缺失会导致IM与ER的稳定结合,从而阻断自噬小体的正常形成。我们还发现WIPI2作为衔接蛋白,与ULK1 / FIP200复合体及PI(3)P的相互作用,帮助ER-IM互作的建立和维持,在VMP1缺失细胞中这些相互作用显著增强。除了ER-IM互作外,VMP1还可以广泛调节ER与其他细胞器,包括脂滴(LD)、线粒体和胞内体的相互作用。
之后,研究人员进一步发现,VMP1是通过激活ER上的钙通道SERCA(肌浆网钙ATP酶)来调节ER与其他细胞器互作的解离。SERCA抑制剂thapsigargin(TG)同样可以增加ER与其他细胞器的互作。
这项研究不仅揭示了ER-IM 互作建立及解离的机制,也阐明了VMP1通过调节SERCA的活性负相调控ER与其他细胞器的互作。
-
项目成果