Immunity:钱友存团队发现肺纤维化疾病的分子机制
特发性肺纤维化(IPF)是一种严重的疾病,被称作“不是癌症的癌症”,因为这种疾病的患者生存期仅2-3年,5年生存率也是低于30%,并且近几年发病率和死亡率也是居高不下,IPF 的病因依旧是未知的,也没有特效药物用于治疗。研究证明促炎性免疫细胞,如巨噬细胞、中性粒细胞、T辅助细胞Th17等在肺纤维化中有重要作用,但是炎症反应如何在肺纤维化过程中被触发和持续存在,仍然未知。
在近期的免疫学顶级期刊(Immunity)上,发表了题为“Dysregulated Lung Commensal Bacteria Drive Interleukin-17B Production to Promote Pulmonary Fibrosis through Their Outer Membrane Vesicles”的文章。这是中科院上海营养与健康研究所钱友存课题组最新研究发现,他们通过分析肺纤维化病理组织中的微环境变化,揭示此疾病发生的分子机制,为治疗该疾病找到了新的靶点。
粘膜微环境是免疫学研究的热点,机体肠道、皮肤等粘膜组织存在大量的共生菌群,广泛参与粘膜组织的稳态维持和疾病发生。肠道微环境研究较多,对于肺部,以前被认为是无菌的,至于感染后才会有微生物存在,但是随着研究的深入,确定正常的肺组织中也存在着丰富的微生物菌群。
钱友存团队一直研究粘膜微环境与白介素-17(IL-17)家族细胞因子之间的关系。比如,紊乱的肠道菌群可以调控IL-17C促进肠癌的发生,而正常的肠道菌群可通过调控IL-17A的分泌促进肠道损伤修复。
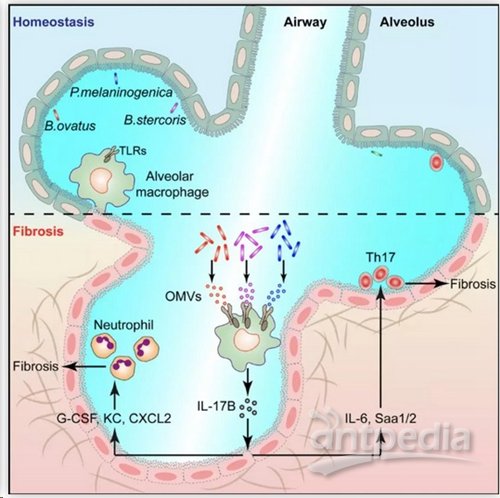
图注:肺组织中升高的微生物菌群通过分泌OMVs调控肺泡巨噬细胞IL-17B的产生从而促进肺纤维化病理发生
首先,研究人员通过抗生素处理、高通量测序等发现正常小鼠肺组织中存在相对丰富的共生菌群,并且在肺纤维化病理组织中菌群紊乱。数据显示IL-17A和IL-17B在小鼠和病人肺纤维化组织细胞样品中表达明显上调,说明紊乱的肺部菌群可能通过IL-17A和IL-17B的表达,调控肺纤维化的发生。
进一步的研究利用流式细胞分选技术,发现IL-17B主要由肺泡巨噬细胞产生,并通过分泌外膜囊泡(OMVs)调控IL-17B的产生。OMVs作用于肺泡巨噬细胞的TLR2、TLR4受体,激活Myd88介导的信号,从而促进IL-17B的表达。IL-17B直接作用于肺部上皮细胞,诱导下游基因表达,促进中性粒细胞的招募以及Th17细胞的分化,进而造成肺部严重的炎症损伤及纤维化发生。
白介素-17(IL-17)家族由六种细胞因子构成,即IL-17A、IL-17B、IL-17C、IL-17D、IL-17E、IL-17F,但仅有五种受体(IL-17RA至IL-17RE),IL-17RA为共同受体。虽然已有报道IL-17A和IL-17E促进肺纤维化,但机制认不清楚,也需要确定IL-17家族其他的细胞因子是否参与肺纤维化。在本次研究中发现IL-17B在肺纤维化中具有不确定的功能机制。IL-17B通过IL-17RB和IL-17RA激活下游信号转导,诱导许多促炎基因表达。IL-17B与TNF-α协同作用,诱导肺上皮细胞中促炎和促纤维化基因表达。
总之,本研究证明紊乱的肺部菌群分泌OMV,激活多种细胞类型中的促炎和促纤维化基因的表达,并且IL-17B与TNF-α“团队合作”形成促进肺纤维化的炎症通路。用抗生素可能对治疗肺纤维化(如IPF)有效果,并且IL-17B可以作为潜在抗纤维化靶点,为相关研究和疾病的临床治疗提供了新思路。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 6215
询底价 Tel:400-6699-117 转 6215 -
精英视角

-
企业风采























