外泌体研究miRNA成果:带你揭秘长期运动对心脏的好处 1
文章导读
众所周知,运动可以降低心血管疾病的发生概率。目前已有的研究报道主要集中在肌肉因子方面,因为它具有旁分泌和内分泌作用,能够协调运动的多系统效应。然而,运动对心脏保护作用的潜在机制目前尚未可知。第四军医大学高峰、王立锋科研团队的最新研究成果表明,长期运动衍生的循环外泌体能够传递心脏保护信号,并鉴定出外泌体miR-342-5p是一种新的心脏保护性运动因子,能够对抗大鼠心肌缺血和再灌注(MI/R)引起的损伤。

发表期刊:Circulation Research
影响因子:15.211
实验方法:miRNA测序
实验材料:长期运动的人和大鼠的血浆(实验组),不运动的人和大鼠的血浆(对照组)
文章内容
1.运动对血浆外泌体数量无影响
本篇文章作者首先收集了运动和久坐的大鼠的血浆,从中分离出外泌体,运动大鼠血浆中外泌体为实验组(exe-exo),久坐大鼠血浆中外泌体为对照组(sed-exo)(图1A),对外泌体进行镜检后(图1B),又检测了两组的外泌体蛋白,结果显示两组间外泌体的量并没有显著差异(图1C),且NTA分析也显示,两组的粒径分布和血浆浓度没有显著性差异(图1D和E)。然后作者用pkh26标记的外泌体和心肌细胞共培养,观察到外泌体在孵育6小时后被心肌细胞内化(图1F)。

图1. 运动和久坐大鼠的外泌体数量无差异;外泌体能被心肌细胞内化
那么问题来了,上述两种情况在人体中是否也存在呢?
于是作者对人做了相同的检测。运动员血浆外泌体为实验组(Row-exo)和普通人的血浆外泌体为对照组(Con-exo),结果与大鼠一致(图2K和L)。此外,作者还发现将运动员的外泌体和人的心肌细胞共培养后,可以降低细胞凋亡(图2M),同时释放血清乳酸脱氢酶LDH(图2O),并能增加心肌细胞活力(图2N)。
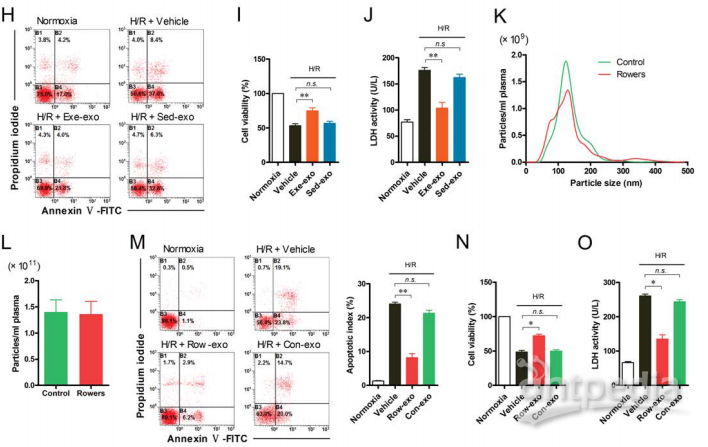
图2. 运动员和普通人的外泌体数量也无差异;外泌体也能被心肌细胞内化
2.运动分泌外泌体(exe-exo)对MI/R损伤有心肌保护作用
首先作者对两组大鼠进行心肌缺血30 分钟,再灌注24小时的损伤破坏,发现与久坐对照组(sed)相比,运动组(exe)大鼠心肌梗死面积减少,LDH降低,表明运动对MI/R损伤有明显的心肌保护作用。
为研究运动分泌的外泌体对心肌保护的作用,作者从两组大鼠的等体积血浆中分离出外泌体,并在MI/R损伤前的48小时,将携带pkh26标记的外泌体注射进正常大鼠心肌。接着对大鼠进行MI/R损伤,24小时后发现,与注射sed-exo的大鼠相比,注射exe-exo的大鼠心脏梗死面积显著减小(图3A),同时伴有LDH降低。此外,作者还发现注射exe-exo的大鼠心脏功能得到改善,如MI/R后保留射血分数和分数缩短4周(图3F-H)。综上,exe-exo对MI/R损伤具有心肌保护作用。

图3. Exe-exo能减少MI/R损伤导致的心肌梗死面积,改善心脏功能
3.miR-342-5p是exe-exo中诱导心脏保护的关键成分
为了探讨miRNA在外泌体诱导的心脏保护中发挥作用的可能性,作者分别对两组大鼠外泌体中的miRNA进行了高通量测序(云序可以提供此服务)。共检测到14个差异表达的miRNAs(图4A),经q-PCR分析进一步验证后,确定12个差异表达的miRNAs,其中11个表达上调(图4B)。接着作者用缺氧/复氧(H/R)模型研究这11种上调的miRNAs如何影响心肌细胞的功能。发现miR-342-5p能显著降低H/R作用下心肌细胞的凋亡,降低LDH的释放,提高细胞活力(图4C-E)。
为了更好地了解外泌体miR-342-5p的功能,作者又检测了血浆外泌体处理的心肌细胞和心脏中miR-342-5p及其前体的水平。心肌细胞经exe-exo孵育和心脏注射48小时后,其中的miR-342-5p水平显著升高(图4G),而前体m iR-342-5p水平无明显变化,表明exe-exo将miR-342-5p传递给心肌细胞或心脏。此外,抑制miR-342-5p可以明显减弱运动型血浆外泌体对心脏的保护作用(图4H-J)。这些结果表明miR-342-5p在外泌体诱导的心脏保护中起着关键的作用。
那长期运动是否会导致人体外泌体中miR-342-5p的差异表达呢?
于是作者检测了运动员训练前后血浆外泌体中的miR-342-5p含量,发现训练后它的表达量比未受训的时候提高了1.8倍(图4F)。

图4. miR-342-5p在exe-exo提供的心脏保护中起关键作用
4.miR-342-5p通过靶向结合心肌细胞中的Caspase 9和Jnk2发挥抗凋亡作用
为进一步研究miR-342-5p的作用机制,作者预测了miR-342-5p的靶基因,发现Caspase3、Caspase9和Jnk2能参与MI/R损伤和凋亡途径(图5A)。接着作者又发现增加miR-342-5p后,可以显著降低Caspase9和Jnk2的蛋白水平,反之亦然,但没有观察到Caspase3基因表达的显著改变(图5B)。接着作者用荧光素酶进一步研究了Caspase9和Jnk2两个基因与miR-342-5p的结合位点(图5C)。此外,exe-exo孵育可以显著抑制H/R诱导的心肌细胞裂解-Caspase3、裂解-Caspase9和磷酸(P)-Jnk2的表达(图5D)。综上,这些数据表明miR-342-5p通过靶向结合Caspase9和Jnk2,在心肌细胞中发挥抗凋亡作用。

图5. miR-342-5p通过结合心肌细胞中的Caspase 9和Jnk2发挥抗凋亡作用
5.miR-342-5p通过靶向结合Ppm1f增强心肌细胞中AKT的磷酸化
生存信号AKT和ERK 1/2已被证实为心脏保护的关键分子。miR-342-5p可以上调心肌细胞中AKT的磷酸化,而ERK 1/2的磷酸化水平没有明显变化(图6A);在H/R心肌细胞中观察到类似的现象(图6B-D)。这些结果表明,miR-342-5p能激活心肌细胞的生存信号AKT。有趣的是,作者发现Ppm1f是miR-342-5p的潜在靶点,这是生信分析预测的唯一磷酸酶(图6E)。如图6F所示,miR-342-5p可以减少Ppm1f蛋白水平,反之亦然。荧光素酶报告分析进一步证实miR-342-5p可以直接结合Ppm1f的3'UTR区(图6G)。值得注意的是,下调Ppm1f蛋白表达不仅显著提高AKT的磷酸化水平(图6H-I),还可以降低H/R诱导的心肌细胞凋亡(图6J),这暗示AKT磷酸化水平升高可能在心肌保护中发挥作用。







