Nature子刊揭示发病新机制 阿尔茨海默治疗迎来新曙光
近日,华中科技大学王建枝课题组与同济大学叶克强课题组等人在Nature Communications上在线发表了题为“C/EBPβ regulates delta-secretase expression and mediates pathogenesis in mouse models of Alzheimer’s disease”的研究论文,研究人员发现C/EBPβ以年龄依赖性的方式调节δ-分泌酶的转录和蛋白水平。C/EBPβ在幼龄3xTg小鼠中的过表达增加了δ-分泌酶,加速了认知功能障碍等病理特征,而AEP C189S则使其消失。相反,老3xTg或5 XFAD小鼠C/EBPβ的缺失则减少了δ-分泌酶,减少了AD的发病,从而改善了这些AD模型小鼠的认知功能障碍。该结果揭示了C/EBPβ通过增加δ分泌酶的表达在AD发病中起关键作用。

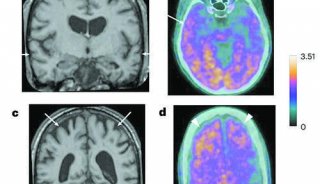
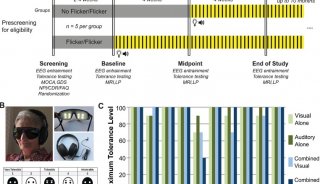
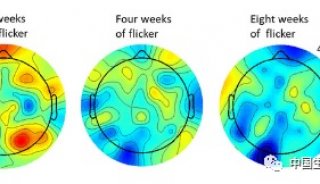
阿尔茨海默病(AD)的特点是脑内β-肽(Aβ)的积累,以及微管相关蛋白tau的过度磷酸化和裂解形式。众所周知,AD的最大危险因素是年龄增加。然而,衰老介导AD发病和发展的分子机制尚不清楚。已知淀粉β前体蛋白(APP)代谢异常和Tau蛋白磷酸化异常导致老年斑和神经纤维缠结(NFT)的形成。这些重要的事件驱动神经退行性变和痴呆的临床表现。最近研究报道,AEP(LeGuMin,LGMN),新指定为δ分泌酶,以年龄依赖的方式切割APP和Tau。老年小鼠和AD脑中δ分泌酶的表达水平和活性逐渐升高。
从5xFAD或Tau P301S小鼠中去除δ分泌酶可改善这些病理性缺陷,并在两种动物模型中挽救认知功能,这表明δ分泌酶在AD发作和进展中起着至关重要的作用。AEP是溶酶体天冬酰胺肽链内切酶,其活化是自催化的,需要在不同PH4顺序除去N和C-末端肽。在以前的研究报道中,AEP裂解集作为DNASE抑制剂并失活集合,导致DNA损伤和神经细胞死亡。此外,SET还起到PP2A抑制剂的作用。AEP裂解组阻断PP2A的磷酸酶活性,导致AD中的Tau过度磷酸化和聚集。因此,δ分泌酶在介导AD发病机制中起着关键作用。
在阿尔茨海默病(AD)中,δ-分泌酶既能切割APP,又能介导淀粉样斑和神经原纤维缠结的形成。然而,衰老是如何促进δ-分泌酶表达和AD病理的尚不清楚。在AD小鼠模型中,CCAAT-增强子结合蛋白(C/EBPβ)是一种炎症调节的转录因子,是一种关键的年龄依赖性效应因子,在AD发病机制中起重要作用,促进了δ-分泌酶和炎性细胞因子的表达。
研究人员发现C/EBPβ以年龄依赖性的方式调节δ-分泌酶的转录和蛋白水平。C/EBPβ在幼龄3xTg小鼠中的过表达增加了δ-分泌酶,加速了认知功能障碍等病理特征,而AEP C189S则使其消失。相反,老3xTg或5 XFAD小鼠C/EBPβ的缺失则减少了δ-分泌酶,减少了AD的发病,从而改善了这些AD模型小鼠的认知功能障碍。因此,该研究结果支持C/EBPβ通过增加δ分泌酶的表达在AD发病中起关键作用。