干货|想get更多的免疫检测技术?毛细管电泳了解一下
现代毛细管电泳技术开始于1981年(文献1),在之后10年作为一种分离技术被使用,并没有得到很大的改进和发展,处于技术停滞阶段。上世纪90年代中期,因为Genentech,Amgen等生物制药巨头的崛起,以及整个生物制药的发展,使得毛细管电泳技术也相应得到了很大发展,到20世纪末期,成为一个成熟的技术(文献2)。
20世纪末,21世纪初,毛细管电泳界也出现了一些新的领军人物,比如华人科学家吴家齐博士作为技术发明人,和其合作者,在加拿大多伦多创办了Convergent Bioscience,推出了第一款全柱成像毛细管等电聚焦电泳(iCIEF法)系统iCE280. 因为其峰形重现性好,且效率比传统毛细管电泳提高五倍,平台方法开发快,迅速成为全球生物大分子药物电荷变异体检测的金标准。

2012年完成欧美11家制药巨头12个实验室的联合验证(文献3),成为欧美市场的标准。之后,Convergent Bioscience被ProteinSimple收购。2018年吴家齐博士作为技术发明人,获得2018 CASSS CE Pharm Award Winner。
2017,iCIEF法完成了中国10家药企联合验证,结果于2018年发表在电泳杂志(Electrophoresis),成为当期Electrophoresis的封面文章(文献4)。2019年3月6日,国家药典委员会公示,全柱成像毛细管等电聚焦电泳法(iCIEF法)作为单抗药物的电荷变异体检测方法。

经典的毛细管电泳技术,包括ProteinSimple的第三代CE,Maurice(iCIEF和CE-SDS二合一),采用紫外检测器等,适合于纯化后的较纯的样本,适用于PD下游,QC阶段的产品放行。
经典方法检测PD上游工艺未纯化的样本是有困难的,同时也没有办法对于CE-SDS检测到的碎片进行识别表征。因而,经典CE,需要在分离,富集样品后,再进一步使用质谱等方法进行片段的表征。因为PD上游工艺会有较多的非纯化样本,且富集后进行质谱的工作量巨大,工艺周期增长等,产生了一系列使用上的问题。因而,一些科学家开始将毛细管电泳技术和免疫学(抗体特异性识别)技术联合起来,开发了毛细管电泳免疫学检测技术。
1、全柱成像毛细管等电聚焦(iCIEF)免疫学检测技术
iCIEF免疫学检测方法过程
第一步:经典iCIEF分离(蛋白质根据电荷进行分离)
第二步:使用毛细管壁交联技术,将蛋白质分子交联于毛细管管壁
第三步:使用anti-IgG等抗体识别混合样本的中的目标IgG分子,通过化学发光的方法进行信号采集。
具体检测原理见下图(参考文献5)
主要技术特点
1. 适合于PD上游阶段未纯化样本,检测酸碱性峰,主峰(结果图1)
2. 化学发光灵敏度提高约1000倍(结果图2)
2、CE-SDS免疫学检测技术
监测和评价单克隆抗体(MAb)中的关键质量属性(CQA)是制药行业的一项监管要求。在活细胞中生产这些复杂的生物大分子时,会产生大量的过程相关杂质,产品相关杂质如高分子量(HMW)和低分子量(LMW),这些杂质可能会危及安全和功效。HMW产品相关杂质引起免疫反应,LMW产品相关杂质可能会影响mAb的生物活性,这取决于剪裁部位的不同。
对药物进行剪裁,会对药代动力学性和安全性产生负面影响。因此,碎片水平必须进行控制,且作为关键质量属性进行质量控制。通常通过分子量排阻色谱(SEC)分离的HMW物质,二聚体、三聚体和/或多聚体,其可潜在地增强免疫应答,导致不良事件并危及患者的安全性和有效性。
LMW片段包括剪切的碎片、抗体亚结构域例如轻链(LC)和重链(HC),以及工艺过程中产生的混合的杂质,HCLC(or HL), HC-HC-LC (or HHL)。
分子量排阻色谱(SEC)是一种常用的检测和控制抗体聚集和片段的方法,但其分辨率差,特别是对LMW片段,极大地限制了其监测LMW的能力。
电泳法,如SDS-PAGE或CE-SDS提供了更高的碎片分辨率,并已成功地用于评估mAb在制药业中的纯度和完整性。然而,SDS-PAGE中每条凝胶条带的识别是很有挑战性的.同样,不能提取CE-SDS峰进一步通过质谱进行鉴定分析。在某些情况下,也观察到相同分子量的工艺相关杂质与小分子量的产品相关杂质的共洗脱,导致杂质总量的量化不正确。
蛋白质印迹也被用于蛋白质类生物药品的表征。但是,由于其固有的缺点,包括劳动密集的过程,较长的处理时间,以及运行不稳定性,限制了它在生物药品中的使用。
2017年施贵宝(BMS)基于ProteinSimple的Wes系统开发了HMW和LMW碎片表征和评价的新方法。Wes是一款CE-SDS结合免疫学检检测的新型毛细管电泳技术,是建立在毛细管系统中基于分子量大小的分离,并在分离后通过特异性免疫方法来检测的,结果证明了该方法对单抗片段的表征能力。

BMS研究一(参考文献6)
使用抗IgG 1蛋白特异性区域(Fc区或Fab区)的两种抗体,表征碎片中的Fc和Fab段。
样品用IDES酶或者热处理IgG 1蛋白产生的F(ab)2和FC2片段。
结果表明,所选抗体对F(ab)2和FC2片段具有较高的特异性。对SEC收集的组分进行评价。从SEC组分中检测到的片段,根据其估计的分子量和抗体检测结果进行鉴定。
下图为检测方法工作图及结果
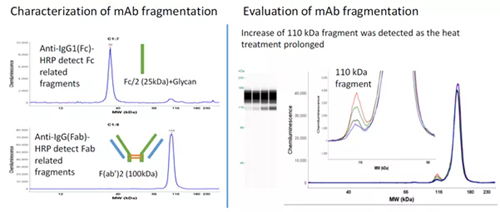
SEC分离片段的表征

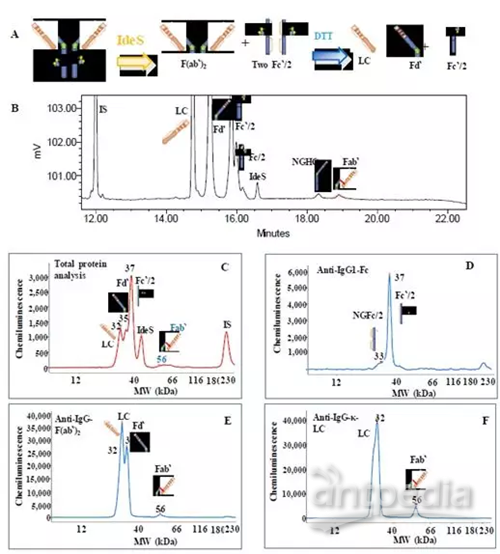
BMS研究二(文献7)
在还原条件进行各种IgG 1 LMW片段的综合鉴定。同时生成互补的CE-SDS图谱,对LMW片段进行比较和定位.通过选择3个抗体药物特异性抗体(针对IgGκ-LC、Fc和Fab区)和IgG1 mAb的总蛋白图谱,对Fc和Fab相关的LMW进行了鉴定和鉴定。
用IdeS、IgdE和PNGase F三种酶消化IgG 1样品,使用CE-SDS免疫检测技术进行鉴定表征。
典型结果举例(IdeS处理)
结语
毛细管电泳(CE)技术是近十年来提高生物制药产品关键质量特性(CQAS)的一种强有力的技术。CE相关技术在质量控制实验室中,用于生物制剂分子的放行和稳定性测试。
毛细管电泳免疫学方法的建立,是对经典的毛细管电泳,及色谱技术的有效补充,对于单克隆抗体早期阶段的研发,产品的表征具有非常重要的意义。
参考文献
1.Jorgenson, J. W., Lukacs, K. D., Anal Chem, 1981, 53, 1298–1302
2.Wätzig, H., Degenhardt, M., Kunkel, A., Electrophoresis, 1998, 19, 2695–2752.
3.Oscar Salas-Solano,J. Sep. Sci. 2012, 35, 3124–3129
4.Gang Wu,Chuanfei Yu,Wenbo Wang, Lan Wang,Electrophoresis,2018
5.David A. Michels, Anal. Chem,dx.doi.org/10.1021/ac3008847
6.Jinyu Wang Anulfo Valdez Yingchen Chen,Journal of Pharmaceutical and Biomedical Analysis,dx.doi.org/doi:10.1016/j.jpba.2016.12.024
7.Yunxiao Zhu, Deepti Ahluwalia, Yingchen Chen, Madesh Belakavadi, Amit Katiyar and Tapan K. Das, Electrophoresiss doi:10.1002/elps.201900119.