珍藏版:详解mRNA疫苗
mRNA疫苗不良反应:短期反应略高于传统疫苗,需要时间验证长期安全性
除了有效保护率外,疫苗的另一重要指标是不良反应发生的种类和概率。总体来说,灭活疫苗因其成熟的技术和研发生产经验,不良反应发生频率较低,反应程度也较为温和。mRNA疫苗则运用了全新的技术,目前得到的安全数据只反映了接种后短期内可能发生的不良反应,是否会对人体造成长期的影响还需要时间进行长期的观察。
从理论分析,mRNA疫苗通过使部分人体细胞表达外源抗原来激活免疫,除了抗原本身会引起免疫反应,这部分表达抗原的自体细胞可能也会引起较强烈的免疫反应。灭活疫苗则是直接呈递抗原,因此免疫反应较小。
(1)辉瑞/BioNTech mRNA疫苗(BNT162b2)安全性
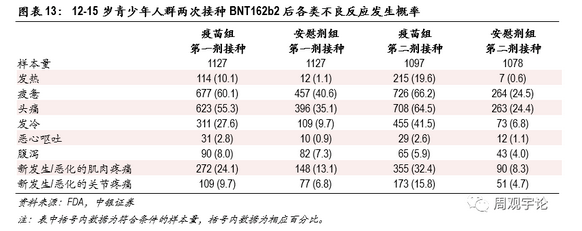
临床试验记录了样本人群每剂次接种后7天以内的不良反应,并将样本人群分为3个年龄阶段:12-15岁、18-55岁、56岁及以上,以研究疫苗对青少年和老年人是否安全。总体来说,第二次接种后绝大多数各类不良反应出现的概率均高于第一次接种后。局部不良反应中,注射处疼痛报告比例较高,第一次、第二次接种后报告疼痛的比例为83.1%、77.8%(对应安慰剂组14.0%、11.7%),其中严重疼痛以致于无法进行日常活动的比例为1.0%、1.2%(对应安慰剂组0.1%、0.0%)。系统性不良反应中报告最多的是头痛和疲惫。在18-55岁主要年龄层的研究中,第一次接种后头痛和疲惫的出现几率分别为41.9%、47.4%(对应安慰剂组33.7%、33.4%),第二次接种后的几率分别为51.7%、59.4%(对应安慰剂组24.1%、22.8%)。其他不良反应中,接种第一剂疫苗后,呕吐、腹泻出现的概率分别为1.2%、11.1%,但安慰剂组的对应概率也分别达到1.2%、11.7%,不良反应出现概率与疫苗组持平甚至更高,因此无法判断此类不良反应的出现是否和疫苗接种有因果关系。相较于第一剂接种,第二剂接种后出现不良反应的概率要更高,出现发热的频率达到15.8%(对应安慰剂组0.5%),发冷、肌肉疼痛和关节疼痛的出现频率也较高,分别为35.1%(对应安慰剂组3.8%)、37.3%(对应安慰剂组8.2%)、21.9%(对应安慰剂组5.2%)。

56岁及以上人群接种疫苗后不良反应的发生频率并未显示出疫苗会对老年群体造成更严重的副作用,老年人群报告的不良反应发生频率甚至略低于18-55岁年龄段的水平。不同种类的不良反应发生规律与18-55岁年龄层类似,头疼和疲惫的发生频率较高。

12-15岁年龄层人群接种疫苗后不良反应的发生规律与其他两个年龄层相似,不良反应发生概率略高于其他两个年龄层。12-15岁年龄层人群接种疫苗后出现发热的概率较高。接种第一剂后的发热概率为10.1%(对应安慰剂组1.1%),接种第二剂后的发热概率为19.6%(对应安慰剂组0.6%)。
根据CDC数据,截至2021年1月18日,接种BNT162b2疫苗后引起的过敏反应在每百万人中仅出现5例,概率极低。
(2)Moderna mRNA疫苗(mRNA-1273)安全性
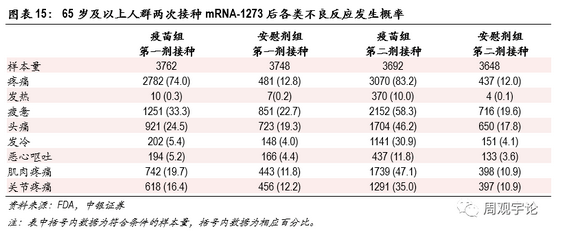
Moderna mRNA-1273的临床不良反应研究记录了每剂次接种后7天以内的不良反应,将样本人群分为2个年龄阶段:18-64岁、65岁及以上,同时每个年龄层中分为疫苗组和安慰剂组。总体来说,第二次接种后绝大多数各类不良反应出现的概率均高于第一次接种后。
局部不良反应中,疼痛仍旧是占比最高的,第一次和第二次接种后报告疼痛的比例分别为86.9%、89.9%(对应安慰剂组19.1%、18.7%)。其中三级疼痛报告比例分别为3.2%、4.6%(对应安慰剂组0.2%、0.2%)。
系统性不良反应中,疲惫报告比例仍旧最高,第一次和第二次接种后报告疲惫的比例分别为38.4%、67.6%(对应安慰剂组28.8%、24.6%),与BNT162b2数据相近。
不良反应种类中,除注射处疼痛外,报告最多的不良反应是头痛和疲惫。在18-55岁主要年龄层的研究中,第一次接种后头痛和疲惫的出现几率分别为41.9%、47.4%(对应安慰剂组33.7%、33.4%),第二次接种后的几率分别为51.7%、59.4%(对应安慰剂组24.1%、22.8%)。其他不良反应中,接种第一剂疫苗后,呕吐、腹泻出现的概率分别为1.2%、11.1%,但安慰剂组的对应概率也分别达到1.2%、11.7%,不良反应出现概率与疫苗组持平甚至更高,因此无法判断此类不良反应的出现是否和疫苗接种有因果关系。相较于第一剂接种,第二剂接种后出现不良反应的概率要更高,出现发热的频率达到15.8%(对应安慰剂组0.5%),发冷、肌肉疼痛和关节疼痛的出现频率也较高,分别为35.1%(对应安慰剂组3.8%)、37.3%(对应安慰剂组8.2%)、21.9%(对应安慰剂组5.2%)。

65岁及以上人群接种疫苗后不良反应的发生规律与18-64岁年龄层类似,局部不良反应中疼痛的出现频率较高,第一次和第二次注射后出现概率分别为74.0%、83.2%(对应安慰剂组12.8%、12.0%)。系统性反应中,头疼和疲惫的发生频率较高。第二剂接种后,发热、发冷、肌肉关节疼痛等不良反应出现概率较第一剂接种后数据上升较为明显。
2款mRNA疫苗的III期临床试验不良反应数据方面接近,局部反应中疼痛最为普遍,在主要人群中第一剂次和第二剂次平均出现概率为82.4%、85.0%(对应安慰剂组16.3%、15.6%)。系统性不良反应中疲惫与头痛出现比例较高,在18岁及以上人群接种第二剂次后,疲惫与头痛的报告比例分别为,三级及以上疲惫的出现概率平均为7.68%(对应安慰剂组0.67%),三级及以上头痛的出现概率为3.99%(对应安慰剂组0.99%)。
(3)国药集团灭活疫苗(WIV04/HB02)安全性
传统疫苗例如灭活疫苗相较而言较为安全,不良反应出现频率低。灭活疫苗采用的技术路径相对简易,外源物质不需要进入细胞(mRNA需要进入细胞质),因此激发的免疫反应较温和。从临床数据来看,灭活疫苗这一技术路径已经过长期不同种类疫苗的验证,并未发现长期对人体有负面影响。
由于统计标准不同,从国药集团2款灭活疫苗的III期临床数据中,我们摘取了第一剂接种后0-28天内(期间部分样本人群接种了第二剂疫苗)发生的不良反应报告。发生最普遍的仍旧是疼痛,平均发生频率为21.8%(对应安慰剂组27.9%),显著低于mRNA疫苗80%左右(对应安慰剂组15%左右)的水平,并且疫苗组数据小于对照组数据。系统性不良反应中,报告频率较高的是疲惫与头痛,分别为11.3%、13.4%(对应安慰剂组10.8%、13.0%),其中三级疲惫与头痛报告比例分别为1.1%、1.0%(对应安慰剂组<0.1%、<0.1%),显著低于mRNA疫苗数据。

从不良反应发生比例来看,灭活疫苗接种后短期内各项不良反应发生比例明显低于mRNA疫苗。虽然三款疫苗临床试验对于不良反应的定义不同,对照组不同,数据收集周期有差别,但数据上巨大的差异仍能或多或少地体现出mRNA疫苗会带来较多较强烈的不适。发热,作为能够进行横向量化对比的不良反应之一,在接种mRNA疫苗后出现频率远远高于接种灭活疫苗后的频率。接种灭活疫苗后发热(38.0°C以上)的发生比例平均为0.4%,38.5°C以上的发生比例为0.2%;接种mRNA疫苗后发热(38.0°C以上)的平均发生比例为17.1%,39°C及以上的平均发生比例为1.7%,均高于灭活疫苗的对应数据。

mRNA疫苗临床数据特点:No pain,no gain
mRNA疫苗同时具有高保护率和相对更多的不良反应。英美俗语“Nopain, no gain” (“没有痛苦便没有收获”),贴切地形容了mRNA疫苗的特点。

mRNA疫苗对新冠病毒的保护率高达94%以上,国药传统灭活疫苗的保护率虽远远高于WHO和FDA建议标准的50%,但不足80%,与mRNA疫苗差距明显。

同时,两款mRNA疫苗均对64岁以上的老年人群展现了非常可观的保护率。BioNTech的BNT162b2对64岁以上群体的保护率为94.7%,仅比16-64岁群体数据低0.4%。Moderna的mRNA1273对64岁以上人群的保护率也高达86.4%,仍旧高于灭活疫苗的整体数据。

mRNA疫苗严重/致命性不良反应罕见但需关注
mRNA疫苗的各项不良反应发生率都较为明显地高出灭活疫苗对应水平,会让接种者在短期内产生更多的不适感。但在临床试验中并未出现严重甚至致命性的不良反应。
各类新冠疫苗在真实世界中开始运用后,不出意外地,开始出现一些此前在实验阶段未曾出现的不良反应,例如血栓伴血小板减少症候群、心肌炎和心包炎等。
根据美国CDC和FDA数据,截至2021年6月21日,美国共有3款新冠疫苗可供使用,分别为2款mRNA疫苗(辉瑞/BioNTech、Moderna)和1款病毒载体疫苗(强生/杨森)。目前美国共接种3.18亿剂次新冠疫苗,其中病毒载体疫苗(强生)接种剂次超1200万剂次,mRNA疫苗超3亿剂次。
综合3款新冠疫苗的数据,接种后发生过敏的概率为每百万人中2-5人(概率0.0002%-0.0005%)。
美国疫苗不良反应报告系统(VAERS)目前接到有关心肌炎、心包炎的报告616起(发生概率0.0001%),CDC和FDA已确定其中393项,其中大部分发生在mRNA疫苗接种后,发生人群集中在男性30岁以下的青中年群体。
CDC和FDA确定了有关接种病毒载体新冠疫苗后发生血栓伴血小板减少症候群(TTS)的报告36例(发生概率<0.0003%),接种ModernamRNA新冠疫苗后发生TTS的报告1例。
VAERS显示接种新冠疫苗后出现死亡案例5479例(0.0017%),其中是否存在和疫苗的因果关系仍需进一步观察分析。
mRNA疫苗与灭活疫苗各有优势,但不可否认的是mRNA疫苗借着新冠疫情的契机已经展示了自己的临床潜力,并且在研发和生产上也具有独特的优势,会在下文详述。
新冠疫情为mRNA疫苗登上舞台带来机遇
mRNA疫苗效果初显,免疫屏障减缓病例新增
mRNA疫苗的临床表现喜人,在现实生活中,mRNA疫苗的针对新冠病毒的有效保护性也得到了宏观数据的支撑。部分国家大规模的疫苗接种逐渐形成了一道免疫屏障,新增新冠感染数量有明显放缓的趋势。
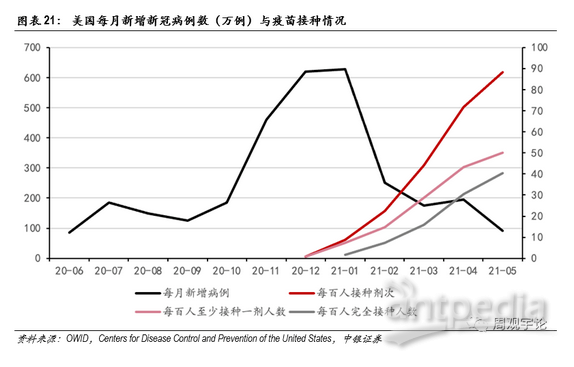
美国是此前新冠疫情最为横行肆虐的国家。根据美国CDC数据,2020年12月美国月新增新冠病例619万例;2021年1月新增达到627万例,累计确诊2613万例,死亡病例数44.8万人,是世界上累计确诊最多,死亡病例数最多的国家。2020年12月下旬,辉瑞/BioNTech和Moderna的疫苗相继获得紧急使用准入。2021年1月20日,新任美国总统拜登上台,并于就职第二天立即签署了数条有关推动疫苗接种的行政指令,并确定了“100天1亿剂次接种”的目标。2021年2月,美国累计接种7524万剂次,每一百人中有14.88人接种了至少1剂次,每一百人中7.41人完成了完整的疫苗接种;3月,累计接种1.48亿剂次,每百人中有28.72人接种至少一剂,15.97人完成完整接种。相应地,美国2月新增新冠病例数下跌至251万例,降幅约60.0%;3月进一步下降至175万例,降幅约30.3%。
数据直观地反映了疫苗接种率与新增新冠病例数之间相反的关系。虽然新增病例数的下降有许多其他因素,但是新冠疫苗毫无疑问是新增数量腰斩的一大主要因素,同时非常明显地抑制了美国的第三波疫情。
短期:国产mRNA疫苗应聚焦海外放量
新冠疫情爆发后,国内各科研机构、企业迅速响应,开始研发针对新冠病毒的疫苗,并且在短短不到两年的时间内取得了亮眼的成绩。截至2021年6月4日,国内获批上市的疫苗包括国药与北京生物、武汉生物研制的灭活疫苗、科兴的灭活疫苗、康泰生物的灭活疫苗、康希诺的腺病毒载体疫苗、智飞生物的重组蛋白疫苗。

短期内,国内新冠疫苗市场已被传统的灭活疫苗占据。截至2021年6月4日,国内疫苗接种剂次已达7亿剂次。18-59岁年龄层为新冠疫苗适龄人群,以2020年第七次全国人口普查数据为标准,我国15-59岁人口约8.94亿人。大部分适龄人群已接受第一剂注射。
大部分疫苗需要多次接种完成完整的免疫过程,在此过程中,接种同一厂家或技术路径的疫苗能够较为稳妥地实现免疫激活的既定目标。目前没有已完成的临床试验可以证实接种不同技术路径的疫苗的安全性,或是能够达到预定的免疫效果。因此,后续疫苗很大可能仍会按照同一厂家同一路径完成接种,短期内mRNA新冠疫苗在国内市场的空间有限。
虽然国内市场已较为饱和,但与此同时,海外疫情持续发酵。2021年3月,全球新增新冠确诊人数1404万例,4月新增2319万例,累计确诊人数也一路飙升。

美国疫情控制已经证实了疫苗带来的免疫屏障能够有效降低新增病例数,建立覆盖全球的免疫屏障是世界经济重回正常的必经之路。由于全球新冠疫苗获WHO紧急使用的种类少,且产能有限,疫苗仍旧处于紧缺状态,尤其是经济科技相对落后的发展中国家。2021年5月,全球新冠疫苗累计接种19.07亿剂次,每百人中接种至少1剂次的约10.73人。根据世界银行数据,2019年全球15-64岁人群占比65.252%,若不考虑患有基础疾病无法接种的人群,则适龄人群中每百人未接种任何疫苗的人数为54.522人。全球人口为77.95亿,则未接种任何新冠疫苗的适龄人数约为42.50亿人,以每人2剂次折算,则理论空间为85.00亿剂次。
全球疫苗产能紧张,拥有疫苗技术和生产能力的国家十分有限,许多国家无法得到疫苗,尤其是经济科技较为落后的发展中国家。因此,新冠疫苗的海外市场有非常巨大的发展空间。
中长期:病毒变异或削弱一代疫苗效力,mRNA疫苗可快速反应应对变异
新冠的大范围传播增加了病毒变异的可能性。现有疫苗能否防范变异病毒成为社会关心的热点之一。普通群众对疫苗有效性感到担忧,投资者则关心是否会影响现有疫苗的放量情况。针对这一问题,mRNA疫苗效力遭到削弱的幅度有限,而对于传统灭活疫苗将会是一个严峻挑战。
mRNA疫苗:锚定S蛋白为靶点,变异影响有限
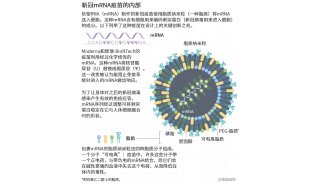
病毒变异对现有mRNA疫苗的影响有限,几乎没有可能出现使疫苗完全失效的情况。现有mRNA疫苗以新冠病毒的刺突蛋白(S蛋白)为抗原,人体产生的特异免疫会以刺突蛋白为标志物,对表达此蛋白的细胞分子发动攻击。因此,若刺突蛋白没有发生显著变异,疫苗激活的特异免疫仍能够识别病毒,病毒其他部分发生变异并不会影响这一识别过程。而刺突蛋白发生明显变异并使病毒维持相同感染能力的几率较小。刺突蛋白是新冠病毒打开人体细胞的钥匙,人体细胞上的对应受体则是锁孔,只有当钥匙与锁孔匹配时才能打开细胞的大门。若钥匙形状明显改变(刺突蛋白发生明显变异),则大概率无法与锁孔匹配,也就无法入侵细胞。因此,刺突蛋白变异会改变病毒的感染机理,大概率造成病毒感染能力丧失或减弱。通过锚定S蛋白,mRNA疫苗仍旧维持了部分针对变异病毒的保护性。长期来看,mRNA疫苗也需要更新迭代,以更精准地适应新型变异病毒。
mRNA疫苗的一大优势是可以通过简单的修改基因序列来产生不同的抗原。若病毒序列变异导致现有疫苗有效率明显下滑,mRNA疫苗厂商可以通过重新对病毒测序来确定变异后的刺突蛋白序列,并以此制成新的疫苗。
此外,mRNA疫苗可以同时包含针对多种不同病毒亚型的对应编码,达到同时激发几种特异免疫的效果。
灭活疫苗:一代疫苗逐渐无法应对多种变异
灭活疫苗依靠失去活性的整个病毒激发免疫反应。因此产生的免疫记忆并不锚定S蛋白,而是针对病毒携带的任意一种或多种抗原,因此每个接种者产生的特异免疫都不尽相同。因此,但病毒发生变异时,此前作为病毒识别抓手的抗原有可能发生改变,导致免疫系统无法识别出病毒。
国内第二轮新冠疫苗需求或为mRNA疫苗带来机遇
国内大规模接种的疫苗品种为灭活疫苗,根据上文分析,以SARS-CoV-2病毒为目标靶点的第一代灭活疫苗在应对病毒的不断变异中,效力会出现下降,造成免疫逃逸的风险。同时,目前公认的灭活疫苗的保护期约6个月,根据我国新冠疫苗接种剂次趋势,2021年底将出现第二轮新冠疫苗的需求潮。
国内新冠疫苗接种次数趋势如下:2021年3月27日突破1亿剂次、4月21日突破2亿剂次、5月9日突破3亿剂次、5月16日突破4亿剂次、5月24日突破5亿剂次、5月30日突破6亿剂次、6月3日突破7亿剂次、6月8日突破8亿剂次、6月15日突破9亿剂次、6月20日突破10亿剂次。每增加1亿剂次的间隔分别为25天、18天、7天、8天、6天、4天、4天、7天、5天,基本呈现出加速趋势。根据全国第七次人口普查结果,15-59岁人口约8.94亿人。以完整免疫需要接种2剂次新冠疫苗为标准,我国本轮新冠疫苗需求量约17.88亿剂次。
由于缺失大部分数据,我们无法得知数据中有多少人已完成整套接种。仅有2021年6月10日当日数据提到截至当日完成整套接种流程的人数,约为2.233亿人。以2剂次为标准,折算为4.466亿剂次,截至当日全国接种剂次总数为8.45亿剂次,用于完成整套接种的剂次数占总接种剂次数的26.42%。按照6个月保护期计算,截至2021年12月10日左右将有2.233亿人需要第二轮新冠疫苗接种。根据2021年6月10日数据,截至当日接种了一剂次的人数为3.984亿人,这一部分群体在2021年7月10日前将接种第二剂次,并且在2022年1月10日前开始进行第二轮的接种,届时国内市场将有约4亿剂次的新需求。