微流控生物芯片上的液体活检技术
以新型生物芯片为代表的自动化智能型医疗技术从肿瘤诊疗研究走向早期诊断及动态监控等临床应用,成为精准医疗时代的重要组成。其中,液体活检是最重要的研究领域之一,在癌症早筛、预后监测、用药指导、患者分层等领域均表现出十足的潜力,出现了大批重要临床结果。
2018年已近尾声,纵览一年液体活检助力精准医疗技术更迭蜕变,美晶医疗微流控芯片ZL技术产品—CellRichTM系统,于年初获CFDA认证批准,作为循环肿瘤细胞(CTC)检测新锐技术产品,展露锋芒,临床与科研项目开展齐头并进,未来可期。此外,该系统作为体外免疫诊断领域的一种新的检测平台,可以实现各种免疫磁微粒复合物(如细胞、蛋白及核酸等)的特异性分离及捕获,有望实现液体中外泌体和ctDNA的提取与分析。
液体活检:应运而生的精准医疗前沿
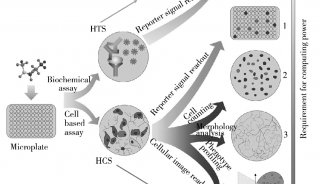
在精准医学的时代背景下,液体活检技术应运而生,与传统组织活检相比,液体活检更能反映肿瘤整体、实时的信息,甚至是全身肿瘤的信息,因此其在肿瘤辅助诊断、疗效评估、病情监测及预后评估等方面显示出独特的优势。随着检测技术的不断完善,液体活检的三大领域CTC、外泌体和ctDNA,在肿瘤精准医疗的临床应用各放异彩。
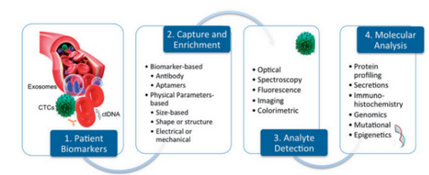
图1 液体活检的概念与流程
微流控技术:芯片助力液体活检
微流控芯片技术是一种在微米或纳米尺寸级别下处理或操纵液体的技术手段,由多个不同的操作单元组成,具有通量高、耗时短、耗材少、可控性强等优势,从而优化检测过程,实现自动化检测,是分析化学、细胞生物学、遗传学等诸多研究领域的重要技术平台。在生物技术研究领域,微流体技术为生物大分子(如蛋白质),小分子(如核酸)等很多标准生物分子检测,如酶联免疫吸附测定(ELISA)、聚合酶链反应(PCR)以及逆转录PCR(RT-PCR)等提供了全新的自动化技术平台。微流控芯片技术已经能够成功地进行液体活检领域(CTC/ctDNA/外泌体)的分析,并实现成果转化,走进产品商业化进程,为临床服务。
下面,我们就来了解一下微流控芯片上的液体活检技术。
循环肿瘤细胞(CTC): 检测日趋成熟
循环肿瘤细胞(CTC)是从肿瘤组织脱落进入外周血的各类肿瘤细胞的总称,是液体活检领域临床研究热度最高的生物标志物。其临床应用价值逐渐得到临床承认,并已先后被写入AJCC癌症分期手册(2010、2018)及乳腺癌NCCN指南(2017.V3)。与此同时,随着微流控技术在液体活检平台应用的不断推进, CTC检测技术也出现了跨越式的发展。在物理学方法上,自根据肿瘤细胞物理学特性通过膜过滤、密度梯度离心等方法进行细胞的粗分离,已发展到基于微流控检测技术的力学、介电泳、大小及变形力等多类型高集成度的富集方法;在免疫学方法上,自单纯的利用免疫磁珠法富集CTC(anti-EpCAM等正向捕获法或anti-CD45等负向富集法),发展到在基于微流控纳米芯片上实现免疫磁珠法的CTC高效分离。
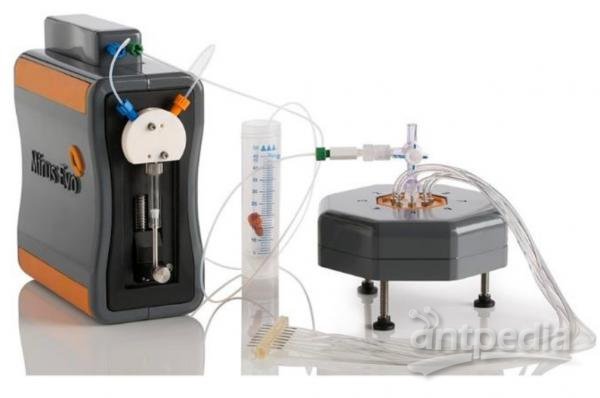
美晶医疗CellRichTM系统是经过中国国家食品药品监督管理总局(CFDA)批准的基于微流体芯片的可融合正、负双向分离方法结合免疫荧光原位杂交技术的检测平台,用于恶性肿瘤疾病管理的CTC检测。并且,随着检测技术的不断改进,CTC检测的应用已不仅仅局限于计数,美晶医疗在高效捕获CTC基础上已建立了多肿瘤标志物、单细胞分析及细胞表达量等相关检测方法,为进一步分析CTC携带的肿瘤基因、蛋白等下游相关组学信息提供技术支持。

图2 CellRichTM循环肿瘤细胞检测系统
近年来的临床研究结果不断刷新并证实CTC计数在肿瘤患者的辅助诊断、预后评估、疗效评估及复发/转移风险评估的应用价值。2018年权威学术杂志《Journal of Clinical Oncology》上发表的由美国多中心联合开展的研究结果,入组6081名转移性去势抵抗性前列腺癌(mCRPC)患者,以基线和治疗后13周后CTC计数和PSA水平的一系列变化作为疗效评价指标,结果表明CTC0(基线CTC≥1,13周后CTC=0)和CTC conversion(基线CTC≥5,13周后CTC≤4)这两个指标可用于评估mCRPC患者疗效及预测预后。但是,CTC的应用价值不止于此,基于CTC的下游分析具有更广泛的前景,如在DNA、RNA、蛋白质水平进行更全面、更深入的分析,为个性化用药及药物研发提供指导意义。来自哈佛医学院的Miyamoto等使用微流控芯片CTC富集技术从前列腺癌男性的血样本中单独分离CTC细胞并进行单细胞RNA测序分析,寻找病人内和病人间的异质性,及它们与初期肿瘤样本的不同之处,揭示了前列腺癌的耐药机制。Yu等从雌激素受体阳性(ER+)的乳腺癌患者血液中,分离CTC,并通过体外培养建立了细胞系。研究发现CTC与原发肿瘤细胞具有相同的组织学和免疫组化特性;CTCs细胞系基因测序结果显示CTCs与实体肿瘤保持着一致的遗传特性,但又拥有一些新的遗传突变,CTCs存在PIK3CA基因突变和新获得的突变基因ESR1和FGFR2;进一步对具有多个突变的CTC细胞系进行药物敏感性实验发现CTCs对紫杉醇和卡培他滨敏感,对氟维司群、阿霉素和奥拉帕尼耐药;动物实验研究发现5株CTCs细胞系中有3株在小鼠上具有致瘤性。以上结果表明CTC体外培养,为药物筛选提供有效方式。
外泌体(exosome):液体活检的风口浪尖
外泌体是一种由细胞分泌的,直径一般为 30-150 nm 的囊泡,携带有大量蛋白质、脂质和核酸等源细胞的生物标志物,在血液、唾液、尿液、脑脊液和母乳等多种体液中均有分布。近年来,外泌体被认为是新兴的临床诊疗的生物标志物,可以揭示来源细胞的生理信息,并直接参与细胞间的信息传递、抗原传递、蛋白转运以及 RNA 转录等重要的生命活动过程,对疾病的发生机制探索和相关疾病的临床诊断具有重大的应用价值。
外泌体作为液体活检的一部分,研究人员利用其物理及生物化学等特性开发了多种分离和纯化外泌体的技术方法。传统常用的外泌体分离方法如超速离心,具有耗时久、通量低及可能损伤外泌体完整性的局限性,适用于大样本量检测。进一步分析外泌体表征的方法主要有蛋白印迹法(Western Blotting, WB)、酶联免疫吸附法(Enzyme-linked immunosorbent assay, ELISA)、电泳、比色、qPCR等。近年来,基于过滤、免疫亲和、免疫磁珠等原理,利用微流控技术在生物芯片捕获并分析高纯度外泌体的方法,在灵敏度、自动化及检测通量等多方面展露优势。但是,与CTC检测相比,基于微流控芯片技术的外泌体检测平台还未有商业化平台,众多科研成果待转化。
另外,基于免疫的方法一直是分离外泌体的重要分支。研究者He等人开发了一种微流控方法,将磁珠集成到芯片上,用于多种外泌体亚群的免疫磁微粒捕获和外泌体靶向蛋白的荧光分析。所开发的带网孔的PDMS芯片巧妙采用多步免疫磁微粒法,如图3所示,第一步,用抗体标记的磁珠捕获目标外泌体;第二步,添加裂解缓冲液,将蛋白质释放到微通道中,用抗体标记的磁珠捕获这些蛋白质;第三步,采用荧光抗体技术分析蛋白质。该免疫磁珠结合微流控技术的方法,仅需30ul样本,外泌体的捕获效率高达99.9%,而且可以方便地制备透射电镜表征样品,这是超速离心等传统方法无法实现的,为微量样本的外泌体分离和分析提供了新的方式。Vaidyanathan等人开发一种通过引入电场来改善特定外泌体的免疫靶向捕获的微流体装置,与常规基于流体力学分离外泌体的微流控系统相比,该技术大大提高了外泌体捕获率。
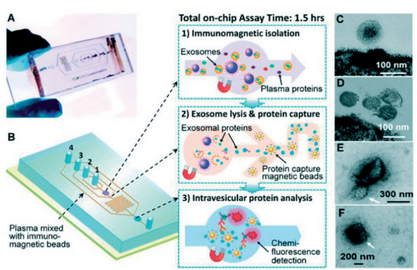
图3 基于免疫磁微粒的微流控外泌体捕获与分析平台
目前,美晶研发团队利用生物芯片技术,结合微流体和过滤两种方法,将由多孔硅纳米线组成的纤毛微柱整合到微流控芯片上,形成微流控过滤系统(图4)。通过优化微柱的几何形状、分布位置与密度,为外泌体提供充足的结合位点,且不影响微流体通道内液体流动,在10分钟内实现外泌体的高效捕获。然后通过溶解多孔硅纳米线,释放外泌体,实现完整外泌体的高纯度回收。以上基于微流控技术分离外泌体的方法,在外泌体的纯度、回收率、生物活性等方面具有突出优势,且具有样本需求量较少的优点,与常规传统方法相比更适用于微量样品分析,有望被广泛应用于未来无创精准诊疗中。当然,当前基于微流控的外泌体分离方法仍处于实验研究阶段,还有待深入研究,以供临床应用。
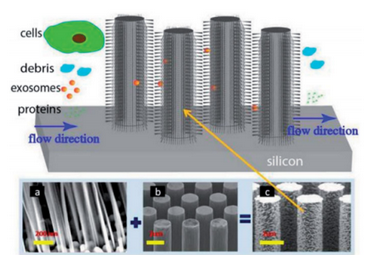
图4有纤毛的微柱阵列分选外泌体示意图
由于外泌体同循环肿瘤细胞一样,具有丰富的内含物,对其进行定量及定性分析对临床意义重大。目前,由于外泌体中的mRNA、lncRNA等RNA,含量较低且不稳定,其临床研究集中于mircoRNA。Jin等使用miRNA-seq对腺癌患者、鳞癌患者及健康人群进行外泌体来源的miRNA分析发现,AC或SCC特异性的肿瘤来源的外泌体miRNA的独特性质,miR-181-5p、miR-30a-3p、miR-30e-3p和miR-361-5p具有腺癌特异性,miR-10b-5p、miR-15b-5p和miR-320b具有鳞癌特异性,并对其诊断准确性进行了验证,表明外泌体miRNA可用于非小细胞肺癌的早期诊断。Ogata-Kawata等人比较了88例结肠癌患者和11例健康对照组血浆中的外泌体的7种miRNAs(let-7a、miR-1229、miR-1246、miR-150、miR-21、miR-223和miR-23a)表达,发现它们在结肠癌患者中的表达显著高于健康对照组;对于I期结肠癌患者,miR-23a和miR-1246同样具有高度的敏感度,分别为95%和90%,而CA199和CEA的敏感度分别只有10%和15%,表明外泌体miRNA可用于结直肠癌辅助诊断。
循环肿瘤核酸(ctDNA):检测任重道远
ctDNA 即循环肿瘤DNA(Circulating tumor DNA),是肿瘤细胞在坏死、凋亡后释放的一种游离DNA,具有和恶性肿瘤相关的分子生物学特征。ctDNA检测具有无创、快速、全面等特点,且能克服组织标本局限性,因此对ctDNA的定量和基因分型分析对肿瘤患者诊断和病情监测具有重要临床意义。
但是,在肿瘤患者外周血循环DNA中,真正来自肿瘤细胞的DNA含量非常低,传统的检测方式是研究者通常需要通过PCR的方式扩大其分子数量,也称芯片式数字PCR法。Sefrioui等人评估了芯片式数字PCR方法是否可用于分析癌症患者的循环DNA,他们入组34名转移性结直肠癌患者进行致病基因 K-ras基因定量分析,研究结果表明该方法用于患者样本ctDNA的定量分析,虽然检测流程相对简单且耗时短,但同时其额外的步骤需要相应的配套设备来配合完成,因此对检测条件有一定的要求。并且,近年来研究发现,单纯基于生物学的方法很难进一步提高检测的灵敏度,且受限于手工操作误差大,而微流控芯片技术的快速发展,为进一步提高检测灵敏度与自动化提供新策略。目前,已有利用磁场,在微流控光学芯片系统中实现cfDNA的快速分离与特异性分析。Dias等人开发了一种基于磁阻传感器阵列的生物芯片上,利用碱基互补配对原理,通过磁珠标记靶向序列,在微流体通道上实现cfDNA靶向序列多步富集和检测。Cai等人开发了一种微流体光学系统(图5),实现人外周血cfDNA的自动化分离与分析。该系统由多层结构组成,首先对血液进行过滤,然后通过磁珠法富集cfDNA,再利用荧光标记目的基因,通过光学系统进行分子分析。此类既不需PCR过程,又可实现目标基因的检测,非常适用于临床样本ctDNA检测推广。美晶医疗CellRichTM循环肿瘤细胞检测系统,是基于微流控芯技术及免疫磁珠富集法的液体活检平台,具有集成性、分辨率高、分析速度快、高通量、物耗少和安全廉价等优点,未来,对基于该平台的液体活检技术进行适当的延伸,同样将在ctDNA高效捕获、分析领域应用具有广阔的前景。
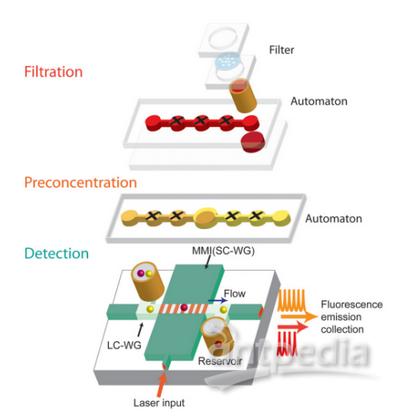
图5 微流体光学系统结构示意图
目前,ctDNA的临床应用方向主要集中于靶向用药指导,如血液样本EGFR基因检测指导晚期非小细胞肺癌患者用药。近年来一项来自日本及欧洲的多中心研究结果提示,对欧洲和日本的晚期NSCLC患者ctDNA检测EGFR突变状态评估研究,发现血浆和组织中的EGFR突变的一致性高达89%,基于这些大量的真实临床数据,目前认为当肿瘤标本不可用或无法获取时,对血浆样本进行ctDNA EGFR突变分析,是一个可行的方案。另外,依据2018年美国临床肿瘤学会(ASCO)和美国病理学家协会(CAP)联合发布的综述文章,表明ctDNA在临床应用范围非常广泛,涉及到肿瘤早期筛查、疗效监测、用药基因检测及复发/转移风险评估等。但是,目前临床有效性数据有限,临床实用性还需建立在技术精准及进一步大数据研究基础上。
结语:液体活检作为一项具有颠覆性的新兴生物医学工程前沿,承载了精准医疗的希望。基于微流控芯片的液体活检技术,正在实现临床转化,成为肿瘤个性化诊疗的重要手段。2018年2月9日,国家食品药品监督管理总局(CFDA)正式审核通过宁波美晶医疗技术有限公司(NanoLite Systems)自主研发的新一代CellRichTM自动化循环肿瘤细胞捕获设备。据悉,该设备是目前国内唯一通过国家认证的基于免疫磁筛选微流控芯片ZL技术的自动化双模式循环肿瘤细胞筛选设备,临床数据显示,可实现人体外周血中肿瘤细胞(CTC)的精准捕获。当然,液体活检要广泛进入临床应用,不仅需要高精准的检测技术平台,还需建立在进一步大量和细化临床研究的基础上,形成相应的检测标准与规范。美晶医疗作为液体活检技术领先的服务商,将以平台为基础,进一步全力推进液体活检领域中外泌体及ctDNA检测技术等相关领域开发及应用,提供全面的液体活检解决方案,为加速中国精准医疗时代的到来贡献力量。
参考文献:
1. Tadimety A, Closson A, Li C, Yi S, T. Shen, Zhang JXJ. Advances in Liquid Biopsy On-Chip for Cancer Management: Technologies, Biomarkers, and Clinical Analysis. Critical Reviews in Clinical Laboratory Sciences. 2018, 55:140-162.
2. Heller G, McCormack R, Kheoh T, et al. Circulating Tumor Cell Number as a Response Measure of Prolonged Survival for Metastatic Castration-Resistant Prostate Cancer: A Comparison with Prostate-Specific Antigen across Five Randomized Phase III Clinical Trials. Journal of Clinical Oncology. 2018, 36(6):572-580.
3. Miyamoto DT, Zheng Y, Wittner BS, et al. RNA-Seq of single prostate CTCs implicates non canonical Wnt signaling in antiandrogen resistance. Science. 2015, 349:1351-1356.
4. Yu M, Bardia A, Aceto N, et al. Cancer therapy. Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 2014, 345(6193):216-20.
5. Jin X, Chen H, Fei S, et al. Evaluation of tumor-derived exosomal miRNA as potential diagnostic biomarkers for early stage non-small-cell lung cancer using next-generation sequencing. Clin Cancer Res. 2017, 23(17):5311-5319.
6. Ogata-Kawata H, Izumiya M, Kurioka D, et al. Circulating exosomal microRNAs as biomarkers of colon cancer. PLoS One. 2014, 9(4): e92921.
7. Chen G, Huang AC, Zhang W et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature . 2018, 560(7718):382-386.
8. Martin R, Koichi H, Baohui H, et al. ctDNA Determination of EGFR Mutation Status in European and Japanese Patients with Advanced NSCLC: The ASSESS Study Journal of Thoracic Oncology. 2016, 11(10): 1682-1689.
9. Merker JD, Oxnard GR, Compton C, et al. Circulating Tumor DNA Analysis in Patients With Cancer: American Society of Clinical Oncology and College of American Pathologists Joint Review. Journal of clinical oncology. 2018, 36(16):1631-1641.