T细胞嵌合抗原受体(CAR-T)疗法新研究进展
CAR-T(Chimeric Antigen Receptor T-Cell, T细胞嵌合抗原受体)免疫疗法为近年来涌现的明星抗癌疗法。两年前,FDA批准Kymriah上市,标志着第一款CAR-T疗法应运而生,在癌症的治疗中展现出巨大的潜力。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。今天小编就给大家梳理一下关于CAR-T免疫疗法的近期新的研究进展。
遏制毒副作用有新招
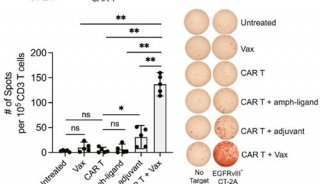
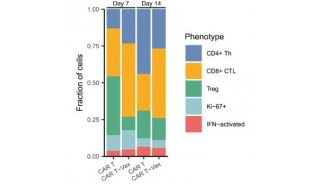
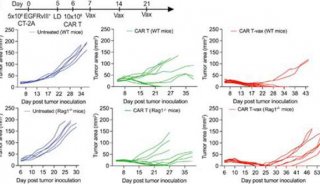
北京大学肿瘤医院与南加州大学的研究人员开发出了全新的CAR-T疗法,在不损伤CAR-T疗效的基础上将毒副作用降至最低。研究人员进行了大规模的抗原筛选,发现一种嵌合抗原受体——CD19-BBz(86)在带瘤小鼠模型中有强劲的灭癌作用,同时其免疫毒副作用相较于传统CAR-T疗法少之又少。
研究人员利用CD19-BBz(86)对现有CAR-T进行改造,让CAR-T成功“变身”,使其携带CD19-BBz(86)特性,并在25名ALL患者中进行了一项小型的早期临床试验。结果显示,在低剂量和中等剂量治疗的患者中,一半出现了临床缓解;在11名接受高剂量治疗的患者中,8人实现了临床缓解(其中6人完全缓解,2人部分缓解),这就说明CD19-BBz(86)CAR-T疗法的疗效有保证。
研究显示,CD19-BBz(86)CAR-T产生的细胞因子远远少于传统CAR-T疗法,显著降低CRS发生的风险。在25名患者中,1级以上的CRS和神经毒性的发生率皆为0!没有一名患者需要药物控制毒副作用,即利用CD19-BBz(86)对现有CAR-T的改造实现了疗效和安全性的双赢。
。。。。。。
近期Nature杂志上的一项研究显示,细胞因子释放与肾上腺素等儿茶酚胺类物质有关。这类物质合成受到限制就可以有效的控制CRS的发生。在本次实验用于抑制儿茶酚胺的合成的药物已经被批准用于临床研究。
“Nature Medicine”杂志同期发表两篇文章,同时发现在CAR-T免疫治疗中避免细胞因子综合征的新方法。这是两个不同研究团队的结果,其中一项研究通过小鼠模型模拟CRS发生的情况,发现IL-1是导致CRS的关键因子,并成功找到一种药物用来抑制CRS。另一项研究也证实IL-1细胞因子的关键作用,但是他们对T细胞进行遗传改造,使CAR-T细胞增加了一个抑制基因以防止CRS的发生。
有关CAR-T如何避免发生细胞因子综合征的研究,还涉及到其它的细胞因子,比如IL-6、GM-CSF。相信随着细胞因子作用机制研究的不断深入,科研人员一定可以让CAR-T细胞治疗在保持最大疗效的同时,防止细胞因子综合征的发生,找到新的药物靶点或机制,避免长期使用激素对CAR-T治疗造成的疗效影响。
CAR-T细胞治疗实体瘤进展
来自美国波士顿儿童医院和麻省理工学院的研究人员发现,微型抗体(mini-antibody)经缩小后可形成纳米抗体(nanobody),可能有助于让CAR-T细胞疗法在实体瘤中发挥作用。
纳米抗体的一种有用的独特性质是增强的靶向能力。研究人员将这些纳米抗体引导到肿瘤胞外基质(ECM)或者ECM靶向显像剂,但这种引导并不是针对癌细胞本身,而是针对包围着癌细胞的肿瘤微环境。研究人员构建的CAR-T细胞上镶嵌着识别肿瘤微环境中特定蛋白的纳米抗体,这些纳米抗体携带的信号引导它们杀死它们能够结合的细胞。一种称为EIIIB的蛋白是纤连蛋白的变体,仅在为肿瘤提供营养物的新形成的血管中发现。另一种是PD-L1,它是一种免疫抑制蛋白,被大多数癌症用于沉默邻近的T细胞。
通过在两种不同的黑色素瘤小鼠模型中进行测试,这些基于纳米抗体的CAR-T细胞杀死肿瘤细胞,显著减缓肿瘤生长并改善这些小鼠的存活,并且没有产生明显的副作用。
。。。。。。
美国拉霍亚免疫学研究所(La Jolla Institute of Immunology)的科学家发现,用Nr4a转录因子缺乏的CAR-T细胞治疗肿瘤的小鼠比没有经过修饰的CAR-T细胞生长得更小,寿命更长。
研究人员制备出两种接受基因改造的T细胞群体:测试组中的T细胞能够识别一种肿瘤抗原,因而在长期接触这种肿瘤后能够变成非功能性的;对照组中的T细胞不能够识别任何肿瘤抗原,因而保持功能性。这就便于他们确定相比于完全功能性的T细胞,在精疲力竭的T细胞内部,是什么发生偏差。
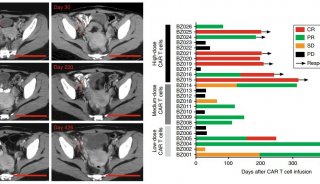
研究人员将制备好的CAR-T细胞进行了基因改造,敲掉Nr4a基因表达的CAR-T细胞和表达Nr4a基因的CAR-T细胞分别注射进入2组小鼠体内,以观察其抗肿瘤效果。结果发现:不表达Nr4a基因的CAR-T细胞治疗的患癌小鼠,大多数都存活了下来,并且即使是在治疗后90天的时间内,小鼠体内的肿瘤依旧被遏制并且在不断的缩小。与之产生强烈对比的是:利用表达Nr4a转录因子的正常CAR-T细胞治疗的小鼠,大多数都在35天左右死亡。
不仅如此,敲除CAR-T细胞中的Nr4a转录因子也会阻断抑制剂受体TIM3和PD-1,而它们本身就是抗肿瘤免疫治疗的靶点。抑制肿瘤浸润性T细胞中NR4A家族成员的功能可能是一种有前途的癌症免疫治疗策略,因为它有望模仿针对多种抑制受体的抗体的联合治疗。
CAR-T药物研究进展
新英格兰医学杂志(NEJM)刊登了CAR-T治疗bb2121的最新临床试验,bb2121是美国蓝鸟公司推出的靶向B细胞成熟抗原(B-cell maturation antigen,BCMA)的新型CAR-T治疗药物。
治疗策略为单次回输bb2121 CAR-T细胞。客观缓释率达到85%,其中45%(15例)为完全缓解。回输到病人体内的CAR-T细胞增殖情况良好,持续保留至少1年。总体来看,bb2121的治疗效果良好,副作用事件和其他CAR-T治疗类似,为多发性骨髓瘤患者提供了新的治疗策略。
而我国的CAR-T研发也正在积极探索,迈入免疫细胞治疗的前沿战场。目前多家国内公司的CAR-T产品受理审批,前期临床结果令人振奋。2018年3月13日,南京传奇的LCAR-B38M获得CFDA的临床试验批件,成为我国首个获批临床的CAR-T疗法。LCAR-B38M对复发或难治性多发性骨髓瘤的治疗有效性,具有非常高的潜在价值。
2018年6月27日,上海药明巨诺公司的CAR-T产品JWCAR029获得国家药品监督管理局(CFDA)批准,成为国内首个获批临床的以CD19为靶点的CAR-T产品。回输CAR-T免疫细胞治疗后29天,6名随访患者的客观缓解率为100%,包括4例完全缓解,2例部分缓解。JWCAR029的初步治疗数据显示其在治疗复发难治性B细胞非霍奇金淋巴瘤的有效性和安全性。
CAR-T的市场分析
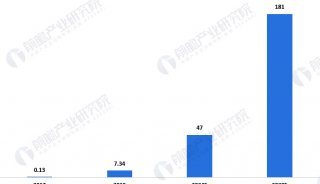
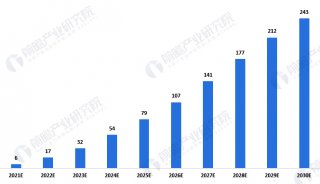
毫无疑问,CAR-T的未来市场是巨大的。到目前为止,Kymriah和Yescarta这两款FDA授权的产品还远远不能满足市场的需求。据(Nat Rev Drug Discov)预计,2026年血液恶性肿瘤药物市场规模最大的几类适应症依次是复发难治性非霍奇金淋巴瘤(包括弥漫大B细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤和慢性淋巴细胞白血病)和多发性骨髓瘤,销售额累计将超过200亿美元,其中CAR-T疗法约占11亿美元,主要是来自儿童和年轻成人急性淋巴细胞白血病患者(44%)及弥漫大B细胞淋巴瘤患者(46%)的治疗。Kymriah和Yescarta主要在套细胞淋巴瘤和滤泡性淋巴瘤方面具有先发优势。
值得提及的是, 基于CD19的CAR-T治疗预期在未来一段时间之内将主导全球CAR-T细胞治疗市场。CD19-CAR-T产品预计在2023年将达到十亿美元的里程碑。许多公司正在使用CD19-CAR-T治疗白血病,与此同时针对其它抗原的CAR-T疗法也预期将为实体瘤的治疗创造显著的收益机会。很多公司都在倾注全力来缩短产品上市时间,以便在接下来的10年中能够把握住这一巨大的市场机会。
不过,CAR-T细胞疗法的发展仍处于起步阶段,Kymriah和Yescarta的高昂定价间接提高了肿瘤治疗的价格上限,也让很多消费者望而却步。降低CAR-T的成本,也应该成为制药公司思考的问题之一。
参考文献:
1. Elisabeth Perez-Ruiz et al., (2019), Prophylactic TNF blockade uncouples efficacy and toxicity in dual CTLA-4 and PD-1 immunotherapy, Nature, DOI: https://doi.org/10.1038/s41586-019-1162-y
2.Yushu Joy Xie,Michael Douganc Noor Jailkhanid Nanobody-based CAR T cells that target the tumor microenvironment inhibit the growth of solid tumors in immunocompetent mice
3.Zhitao Ying,et al.A safe and potent anti-CD19 CAR T cell therapy.Nature Medicine (2019) .
-
科技前沿

-
项目成果