从瑞德西韦看特效药临床实验:III期和同情用药的区别
瑞德西韦英文名Remdesivir,网友们用中文拼音翻译成:人民的希望。
不得不说译名太贴地气了!
先看近期新闻,所有数据以官方为准!
先回顾一下这个疫情相关药以及检测的历史流程,从12月初开始。
1.20200123:美国专家:正与中国合作研发新型冠状病毒疫苗,一年后或上市(机构:贝勒医学院、德克萨斯大学、纽约学业中心、复旦大学)
2.20200123:武汉新型冠状病毒肺炎:疫苗和抗体上路(比尔盖茨基金会、Novavax公司)
3.20200124:Moderrna正开发疫苗,该公司曾经40天生产一种抗癌疫苗,这次用同样技术(CEPI、Moderna公司)
4.20200124:最短6个月量产,昆士兰大学正开发疫苗(CEPI、澳洲昆士兰大学)
5.20200124:美国国家卫生院宣布研发疫苗(美卫生研究院)
6.20200125:中科院上海药物所和上海科技大学联合研究团队发现一批可能有治疗作用的老药和中药(中科院上海药物所、上海科技大学)
7.20200127:中国疾控中心开始研发疫苗(中国疾控中心病毒所)
8.20200127:上科大和中科院上海药物所联合公布病毒3CL水解酶晶体结构
9.20200127:华大基因试剂盒国家局应急审批(华大生物)
10.20200127:捷诺检测试剂盒成功完成注册
11.20200127:沈药科、华中科大、军医学研究院团队发现可能用于治疗的药物
12.20200128:GeoVAs Labs与武汉博沃开发疫苗
13.20200128: 李兰娟:已分离散珠病毒,接下来研究新疫苗
14.20200128:达安基因获批试剂盒注册证
15.20200128:圣湘生物试剂盒获注册证
16.20200129:澳科学家实验室培养出病毒毒株
17.20200129:药明生物加速赋能多个抗病毒中和抗体研发
18.20200131:伯杰医疗试剂盒上市
19.20200130:中国药科大学筛选出多个抗病毒活性小分子(陈亚东课题组)
20.20200201:吉利德关于应对病毒的声明(瑞德西韦Remdesibir)
21.20200201:《新英格兰医学期刊》介绍美国首例感染者的治疗过程及临床表现
22.20200201:中科院上海所研究团队体外实验证明双黄连有抑制效果
23.20200202:智飞生物签订开发疫苗框架协议
24.20200202:中日友好医院在武汉牵头瑞德西韦临床研究
25.20200203:冠昊生物联合美参股公司开发疫苗
26.20200204:李兰娟团队发布抗病毒研究结果,阿比多尔能有效抑制病毒
27.20200204:华为云联合多家研究机构筛选5种可能以有效的药物
28.2020204:燧坤智能:人工智能抗原表位预测应用于研究疫苗
29.20200205:我国学者在抗病毒筛选方面取得重要进展(武汉病毒研究所,瑞德西韦和磷酸氯喹在体外有抑制效果,知识产权)
30.20200205:GSK宣布与CEPI(流行病防范创新联盟)合作,推进疫苗研发
31.20200205:中国前沿生物与中科院上海药物所达成新药开发合作
32.20200205:Lancet在线发表金银潭医院、瑞金医院研究成果,指导临床诊治
33.20200205:德国研究结果:盐酸溴己对病毒反击
34.20200206:瑞德西韦临床试验:761例患者今日接受用药(中日友好医院与协和药物所)
展示这个数据,只是想说明,全世界研究团队都在为抗击冠状病毒做出了大量努力。
瑞德西韦只是其中一个,因为发表了一例美国治愈案例被寄予厚望。
当然科普之前,也要来回顾这个案例来龙去脉
吉利德科学的神药:Remdesivir瑞德西韦

20200201:医学界的神刊《新英格兰医学期刊》(The New England Journal of Medicine,吉利德发表)介绍美国首例感染者的治疗过程及临床表现,
美国针对美国首例感染者使用吉利德的瑞德西韦后疗效较好。(瑞德西韦是一种核苷酸类似物前药,能够抑制依赖RNA的RNA合成酶(RdRp)。原先,这种在研疗法计划用于埃博拉病毒治疗,但冠状病毒里同样有RdRp。因此,这种在研疗法也有望对冠状病毒进行抑制。)
为了严谨的数据支持,在专业的医疗信息库里面做了数据查询。
a.瑞德西韦临床历史:
20200206中国临床数据库ClinicalTrials上显示瑞德西韦共有过2次临床记录,一次是针对埃博拉病毒,另外一次则是针对本轮新型肺炎病毒。2019-nCoV
下图:

b.临床方案:根据数据库显示临床使用的是随机、双盲的临床3期,预计入组308人,预计开始时间是20200205,临床研究结束时间是20200427,主要数据完成时间在20200410.
这是这一轮临床研究的官方时间表!理论上最快出结果时间是4月10日!

c.临床终点检测:从数据中显示,TTCR(Time to Clinical recoveryTime toClinical Recovery临床康复研究时间)最大达到了28天
TTCR代表用药最大时间,28天依然无效的话,就暂停用药。
如果3天就完全好了,就3天结束了,最多给药28天!

从以上临床方案中可以看出来,1天或者2天用药就能出现大规模病人“奇迹”般的疗效基本不可能发生,这更多的只是大家对抵抗疫情的一种美好希望。希望是美好的,但是药物研究是非常复杂的科学研究,不能单靠希望支撑,也不能用个案去无根据推理全局,需要等待系统的、全面的的临床数据来验证我们的美好希望。
吉利德在积极行动
20200201:
吉利德关于应对病毒的声明(Remdesivir瑞德西韦)
瑞德西韦未在任何国家获批,未在研药物,治疗医生权衡风险和获益后提出用药请求,在当地药监机构支持下用药,用于少数感染者的急症治疗。
吉利德配合中国卫生部门开展一项随机、对照试验,以确定安全和有效性;
20200202:
中日友好医院牵头临床:中日友好医院在武汉牵头临床研究(在武汉疫区开展)曹彬教授负责
20200204:
药物到达中国,正式在金银潭医院启动临床,临床注册审批工作完成;
科技部、卫健委和药监局等支持,瑞德西韦完成临床注册审批工作,第一批病例入组工作就位.
20200205:
2月5日下午,武汉金银潭医院召开治疗项目启动会
王辰院士在启动会表示:各界对试验有期望,但有无效果,需试验结果验证;
临床:入组761例:中、轻症患者308例;重症患者453例;
吉利德在发给媒体的邮件中表示,吉利德已与中国卫生部门达成了协议,支持对2019-nCoV感染者开展两项临床试验,以确定瑞德西韦(Remdesivir)作为冠状病毒潜在治疗手段的安全性和有效性。其中一项研究评估瑞德西韦用于确诊感染2019-nCoV且已住院但未表现出显著临床症状(如,需要额外吸氧)的患者的治疗效果,
另一项研究则评估瑞德西韦用于出现较严重临床症状(如,需要吸氧)的确诊病患的疗效。这两项临床试验由中国研究人员牵头,均在武汉进行。
吉利德无偿提供研究所需的药物,并为研究的设计和开展提供支持。临床为严格随机(患者吃的药物按安慰剂组、全量组、半量组等随机发放)、双盲(医生患者都不知道是否为安慰剂还是瑞德西韦);
以上就是流程科普,下面是一些大家关心的问题:
最权威的官方发布机构:卫健委!
国家卫健委新闻发布会是官方唯一发布机构,以此消息为准!
一、创新药物从研发到上市需要哪些环节?目前吉利德处于哪个步骤?
创新药的周期一般是10年或以上,步骤如下:
1、早期研发(发现靶标、了解机理等;)花费时间不等(吉利德的药物早就完成了)
2、临床前研发(体外、体内安全性和活性;体外有酶水平、细胞水平等;体内有各种层次的动物)(吉利德药物以前针对其他适应症也在以前完成了,但新冠肺炎这个病,武汉病毒所完成部分)
3、注册申报(向国家药监局提交申请)分2阶段:
临床申请;临床分I、II、III期(大部分药是需要5年的);
临床结束或基本结束,就进行报产申请。(最近得到国家药监局特批,正在进行的)
4、批准上市后,企业进行生产。
特殊时期,吉利德的库存不止为应对埃博拉疫情,同时也在扩产为新冠肺炎的临床试验在备货,以备不时之需。

二、临床数据分析是什么流程?
1、首先临床方案设计:依据一定科学性设计方案,比如双盲几个周期是否交叉等;
2、按照方案进行临床试验,期间可能会有或大或小更改(大更改都要被批准);
3、揭盲,分析对比数据。(如果吉利德的瑞德西韦(Remdesivir)有奇效,那可以提前揭盲(比如用药一周到2月13日后就可以),揭盲能证明真的是药物安全有效,就可以直接大规模用药。如果效果不是很惊喜,那就会按照原来的试验方案进行结束后揭盲,分析数据。
三、什么叫随机,双盲,安慰剂对照?
双盲指患者不知道吃的是什么,医生也不知道哪个患者吃的药还是安慰剂。这样的做法可以排除患者和医生主管因素对研究结果的影响。
四、什么叫同情用药?吉利德的药可以申请同情用药吗?
同情给药有2个要求:
1、有部分数据证明药物极有可能有效(未上市的药物);
2、市场现有治疗手段无有效或无更好的药物/手段治疗。患者没在临床试验入组,但是又急需这个药,就允许在开展临床试验的机构内使用给急需的患者。
根据美国药品法规定和管理流程,美国那例治愈的患者就是被同情用药了。在中国新的药品管理法对同情用药也有了规定,需要向药监局进行申请。其实除了目前除了吉利德的药,临床上同步也有很多其他抗病毒药在给药。
只要吉利德初步证明有效,也没有其他药物发现能更好治疗肺炎,那肯定是可以立马扩大使用范围的。特殊情况下,更上级的行政单位(如国务院特别小组等),不太用考虑药监局(下行单位)的法规限制。所以必须是吉利德最快出来部分数据证明其有效,(如果无效就大规模使用了,以后不管从媒体还是从大众伦理,都会被批死。甚至是国外的机构和组织都会抓住抨击中国政府。)
有人问如果重症即将面临死亡能否同情用药?答案是需要根据情况,临床上需要判断风险/受益比,比如吃药的风险可能比不吃药死的更快,这样肯定会不给用药,如果反过来,是可以个特殊给药的,只要经过审批。
五、特殊时期会有什么特殊处理方法?
其实现在最耗时的是确定该药物是否安全有效,如果确认,肯定所有的行政审批都能绿灯,不能用常规的行政审批流程来计算。
针对临床上可能出现的状况,做不同的推测。我们可以着重分析大概什么时间段可以判断有效、如有效多久能大规模用上药物。
结论部分
人们对药物能够立马对疾病起到立竿见影的抑制是无可厚非的美好期许,但是任何创新药物批准用于临床,都是需要经过严格的临床试验来验证其安全性和有效性,否则药物不能治不了疾病,反而会危害人的生命。
从公布的数据显示,瑞德西韦需要在4月底才能完成全部临床研究,但是因为是特殊时期,肯定会在更早的时间就能得到该药物初期的临床研究结果。
如果疗效比较理想,预计最快可能也要有2周的时间
能提前揭盲,即达到一定时间后提前分析临床数据,看是否如预期和希望的一样证明瑞德西韦在新型肺炎上是有非常明显效果,如果通过临床数据证明瑞德西韦在人体试验中不但安全(在用于人体的剂量下不会死人,也不会给人造成很大伤害),同时和安慰剂相比有非常明显的疗效(能够积极甚至是治愈患者)。那么在政府相关部门和专家的讨论和批准下,瑞德西韦将很快用在更多病人身上。
科学就是有很大不确定性因素,不一定按照我们期望的方向走,瑞德西韦有可能没有那么神奇的疗效,疗效不那么神奇的时候,则临床进展需要按照开始计划的进程揭盲、分析数据。甚至如果临床用药过程中,效果非常差,遇到多起事故,存在提前结束临床的可能性。
最后引用白岩松对话王辰院士,来做全文总结,同时,希望大家看完科普后,尊重科学,尊重医学研究,勿传播非官方消息!
白岩松:我们现在跟这个病毒有了一段时间的交往了,最初的时候它是陌生的,它是第7种,现在我们是否对它已经有了足够多的了解,到了什么程度?
王辰:还很有限,这个时间太短,科学是有一定过程的,必须以非常冷静的目光、清晰的头脑和缜密的行动来推动科学研究。坦率的说,到目前为止,我们对这个病毒的了解还是有限的,欣慰的是从我们国家从对这个病毒种类的确认,到它的核苷酸序列的确认,到它初步的生物学性状,再到病毒感染的动物模型的建立,已经为后来的研究打下良好的一个基础。我们期望在不久的将来尽快的能够产成对这个病毒的本身的特性,发病规律和应对方法的一系列的科学和技术成果。
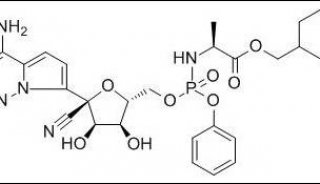
瑞德西韦合成路线:



附录:
“同情用药”在中国适应已有法律基础
根据目前披露的临床试验信息,此次在中国开展的瑞德西韦(Remdesivir)治疗2019-nCoV新型冠状病毒临床研究主要针对轻度和中度患者。也就是说新型冠状病毒感染肺炎的重度患者并不能纳入临床试验中。
“从一般临床设计角度上可以理解,重症的话一般来讲风险会更大,也有基于病情的阶段特征考虑,这个可以理解。”丁胜表示,是否可以早期探讨由研究者发起通过类似于同情用药、真实世界证据支持药物研发等方式针对重症患者和并发症患者治疗、医务人员预防感染等方面开展小型的临床研究。
事实上,美国首例新型冠状病毒患者能够用上瑞德西韦正是适用了美国“同情用药”制度。按照美国食品药品监督管理局(FDA)的规定,同情用药(Compassionate Use)也被称为“扩大使用(Expanded Access)”“病人使用(Named-patient Use)”,指对于患有严重或危及生命疾病的患者,在不能通过现有药品或入选临床试验来得到有效治疗时,可以申请在临床试验之外使用未经上市许可的试验用药物。
好消息是,去年12月1日开始实施的我国新《药物管理法》第二十三条也首次以法律形式原则性地确立了同情用药制度。
但是具体如何实施还有许多问题待厘清,中伦律师事务所律师左玉茹对澎湃新闻表示,对于同情用药制度的具体规范与操作,如:什么药物可以适用同情用药;什么样的疾病可以用药;同情用药的医学伦理标准如何把握;由谁负责审查;医疗机构及医药企业给予知情同意的告知义务等问题,尚待详细的落地措施。
“2017年食药监(原国家食品药品监督管理总局)其实发布了一个关于扩展同情用药的规定,但是到目前为止,还没有正式发布。” 左玉茹表示。
如果在这次疫情中要启动同情用药制度,具体的实施和审查可以依据《拓展性同情使用临床试验用药物管理办法(征求意见稿)》来实施吗?
“原则上可以参照这个办法来推进,这个办法中规定了拓展性同情用药需要得到药审中心的批准,批准时间是30天,在当前情况下这个程序显然无法满足现实需求,因此可以特事特办,直接向药品主管部门审评中心申请立即使用。”清华大学法学院教授王晨光对澎湃新闻表示,申请主体可以是有法人资质的企业或研发机构,包括药品临床试验机构。
“现在药品管理法没有明确由哪个部门进行审查,我们可以从同情用药的属性上去判断,同情用药本质上是临床试验的延伸,所以管理的部门也不会超出这个范畴,那临床这条线上主要就是研究者、研究机构、伦理委员会,最高的评审机构就是药品评审中心。” 左玉茹分析,2017年的《拓展性同情使用临床试验用药物管理办法(征求意见稿)》要求同情用药由药品审评中心来审查,但是但是最新的药品注册管理办法是让伦理委员会来审查。
但是左玉茹提到的这两个涉及同情用药详细实施细则的文件目前都没有正式颁布。“我个人的感觉,考虑到在疫情当中适用影响范围比较大,伦理委员会恐怕不敢担这么大的责任,由药品审评中心来审批的可能性更大。“左玉茹说。
同时左玉茹也建议,面对当下每天不断增长的冠状病毒感染者死亡数量,不能寄希望于瑞德西韦一药定乾坤,但在如此严重的公共卫生事件中,尤其是在前所未见的新型病毒的应对中,在平衡安全与保障知情同意的前提下,尽量增加新型药物的可及性总是方向不错的尝试。
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件




















