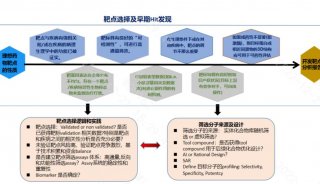
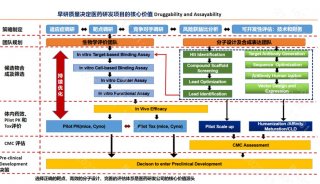
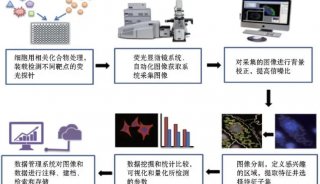
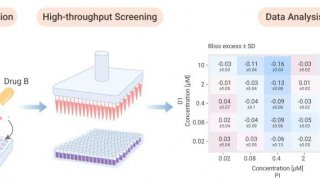
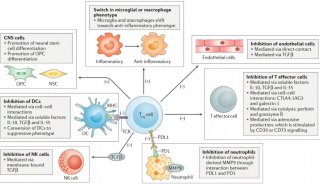
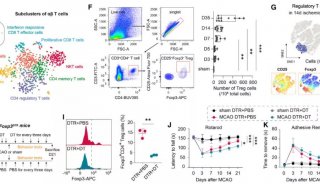
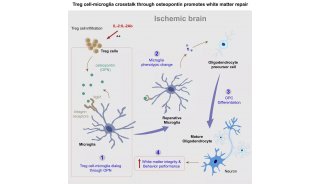
家族性高胆固醇血症(FH)新药!治疗10岁及以上儿科患者
Repatha是一款PCSK9抑制剂类降脂药,在中国已获批3个适应症。
安进(Amgen)近日宣布,美国食品和药物管理局(FDA)已批准Repatha(瑞百安®,通用名:通用名:依洛尤单抗,evolocumab):该药是一款PCSK9抑制剂类新型降胆固醇药物,作为饮食控制和其他低密度脂蛋白胆固醇(LDL-C)降低疗法的辅助药物,治疗10岁及以上杂合子家族性高胆固醇血症(HeFH)儿科患者。
此外,FDA还批准Repatha作为其他LDL-C降低疗法的辅助疗法,用于治疗较年轻的纯合子家族性高胆固醇血症(HoFH)儿科患者。之前,Repatha已被批准用于治疗13岁及以上HoFH患者,现在可用于治疗10岁及以上患者。
家族性高胆固醇血症(FH)是一种遗传性疾病,在早年时便可导致LDL-C水平升高。FH分为杂合型和纯合型。HeFH是更常见的FH类型,全球每250人中就有一人患病。从出生时开始,高水平的LDL-C会加速动脉粥样硬化性心血管疾病(ASCVD)的发展,导致在早年发生心血管事件的总体风险增加,包括心脏病发作和其他血管疾病。FH儿童可表现为体重正常、饮食良好、运动充足,但LDL-C水平仍然很高。由于儿科FH是一种公认的可导致早发冠心病的病症,因此获得可显著降低LDL-C的治疗方法,这一点至关重要。
安进研发执行副总裁David M.Reese博士表示:“FDA批准Repatha用于FH儿科患者,对于采用其他降脂药物无法管理高水平LDL-C的遗传性高胆固醇儿童患者群体来说,代表了一种急需的辅助治疗选择。这一里程碑进一步强化了Repatha的安全性,并与安进致力于解决高风险心血管社区未满足需求的承诺相一致。”
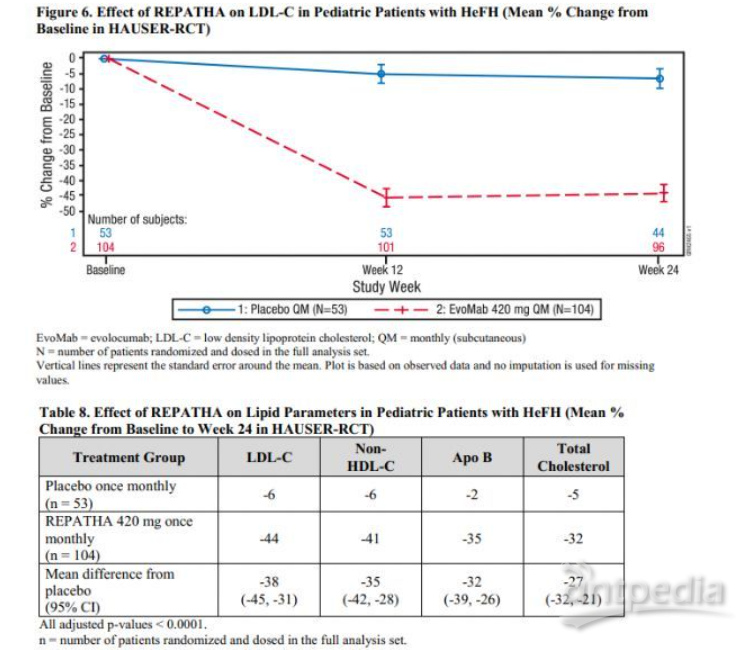
HAUSER-RCT研究数据
此次批准基于HAUSER-RCT 3b期研究的结果。该研究在10-17岁HeFH儿科患者中开展,评估了Repatha的安全性和有效性。结果显示,该研究达到了主要终点:与安慰剂相比,每月一次Repatha治疗将LDL-C平均降低了38%(95%CI:45%,31%;p<0.0001)。LDL-C的降低在第12周时间点的首次基线后评估中就观察到了,并在整个试验过程中保持。
与安慰剂相比,接受Repatha治疗的患者,从基线检查时起次要脂质参数表现出改善,包括:第24周非高密度脂蛋白胆固醇(non-HDL-C)降低35%(CI:42%,28%)、第24周总胆固醇降低27%(CI:32%,21%)、第24周载脂蛋白B(ApoB)降低32%(CI:39%,26%)。
该研究中未发现新的安全风险。最常见的治疗期不良事件(Repatha治疗组发生率>5%且高于安慰剂组)包括鼻咽炎、头痛、口咽疼痛、流感和上呼吸道感染。
Repatha是一种人单克隆免疫球蛋白G2(IgG2),针对人前蛋白转化酶枯草溶菌素kexin 9型(PCSK9)。该药与PCSK9结合,抑制循环PCSK9与低密度脂蛋白(LDL)受体(LDLR)的结合,从而阻止PCSK9介导的LDLR降解,使得LDLR可重新循环回至肝细胞表面。通过抑制PCSK9与LDLR的结合,Repatha增加了能够清除血液中的LDL的LDLR的数量,从而降低LDL-C水平。
截至目前,Repatha已在75个国家和地区获批,包括美国、日本、中国、欧盟所有27个成员国。在其他国家的申请目前正在进行中。
在中国,Repatha(瑞百安®,通用名:通用名:依洛尤单抗,evolocumab)于2018年7月首次获批,成为首个治疗成人或12岁以上青少年纯合子型家族性高胆固醇血症(HoFH)的PCSK9抑制剂。2019年1月,Repatha获批新适应症:用于已有动脉粥样硬化性心血管疾病(ASCVD)的成人患者,降低发生心肌梗死、卒中以及冠脉血运重建的风险。此次批准,使Repatha成为中国市场第一种可用于该适应症的PCSK9抑制剂。
2019年11月,Repatha获批更广泛的适应症:成为中国首个获批用于成人原发性高胆固醇血症(包括杂合子型家族性高胆固醇血症[HeFH])和混合型血脂异常患者的PCSK9抑制剂。
-
企业风采

-
科技前沿
-
政策法规

-
财报

-
焦点事件

-
焦点事件
-
焦点事件
-
焦点事件

-
科技前沿

-
焦点事件
-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件
-
会议会展

-
焦点事件
-
科技前沿
-
焦点事件

-
精英视角

-
科技前沿
-
焦点事件

-
焦点事件
-
市场商机

-
科技前沿
-
产品技术
-
市场商机
-
科技前沿

-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
技术原理
-
科技前沿

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
市场商机
-
焦点事件

-
焦点事件
-
项目成果

-
焦点事件
-
焦点事件
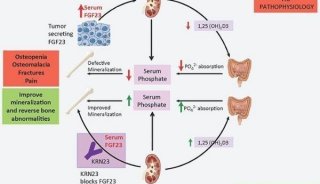
-
项目成果
-
项目成果
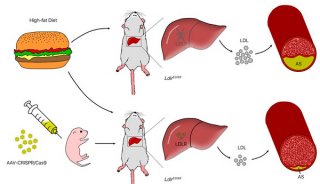
-
焦点事件

-
焦点事件
-
产品技术

-
项目成果
-
科技前沿

-
科技前沿