《科学》:机械应力成为打开蛋白折叠的新方法
在一项最新的研究中,美国科学家利用机械应力,成功打开了细胞骨架蛋白(Cytoskeletal proteins)的折叠(protein folding,简单说来,蛋白折叠就是肽链形成各种空间蛋白结构的过程)结构。这一结果加深了科学家对细胞行为的理解,并有望为药物开发提供新的标靶。相关论文发表在8月3日的《科学》杂志上。
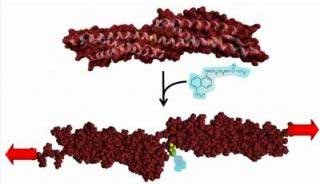
细胞每时每刻都在承受各种机械力的作用。其中一些力是由肌体内部的流动性产生的,比如血液流过血管;而另一些力则来自细胞之间的相互作用。在最新的研究中,美国宾夕法尼亚州立大学的化学与分子生物学教授Dennis Discher领导的小组正是利用机械应力,诱导细胞骨架蛋白产生了构象变化。随后,研究人员通过荧光标记,测定了这些蛋白的分子序列,查明并绘制了一些隐藏的蛋白绑定结合位置,这些位置在细胞处于静态和自由状态时是无法发现的。
研究人员分别针对红血球和干细胞进行了类似的实验,都取得了成功。这一结果突破了长期以来,科学家打开蛋白折叠需要借助化学反应的一般方法。
生物体内的各种生化反应(比如细胞分化)都离不开蛋白质,而蛋白质的装配结构和反应特性则是这些过程的基础。从许多病理学问题,比如心脏病、贫血以及肿瘤硬化等都能够反映出蛋白质组成和装配发生了改变,进而影响到了细胞周围的静态环境和动力学机制。因此,研究人员通常使用蛋白的某些区域作为新型药物开发的标靶,但前提是他们必须了解各种蛋白的折叠、装配和性能等。
对细胞骨架蛋白而言,它们的折叠错乱是引发许多疾病的主要原因。此外,细胞内骨架蛋白的柔性对于细胞间的力学相互作用也有至关重要的影响。这一点对于在肌体内引入干细胞进行治疗的意义非比寻常。
科学家如果能进一步了解蛋白折叠形成的信号途径、蛋白折叠的各种力学特性以及对细胞活性的影响,新的治疗方法就必将会不断涌现出来。
图片说明:蛋白折叠在机械应力的作用下会被打开(图片来源:Dennis Discher and Colin Johnson)
相关阅读(英文)
相关报道
《科学》:蛋白折叠研究新突破
生物通
利用机械力,来自美国费城宾西法尼亚州大学和Wistar研究所的研究人员成功打开了细胞骨架蛋白(Cytoskeletal proteins)的折叠结构。这项公布在8月3日的《科学》杂志上的研究加深了研究人员对细胞行为的了解,并且可能为药物开发提供新标靶。
已经知道,细胞每时每刻都在承受各种机械力的作用:一些力是由肌体内部的流动产生的,而另一些力则来自细胞之间的相互作用。
在这项新的研究中,Dennis Dische教授领导的研究组正是利用机械应力来诱导细胞骨架蛋白产生构象变化。接着,研究人员利用荧光标记方法测定了这些蛋白的分子序列,进而确定出一些隐藏的蛋白绑定结合位点——这些位点在细胞处于静态和自由状态时是无法发现的。为了确定受压力细胞中改变构型或装配的细胞骨架蛋白,研究人员利用荧光基团对在空间位置上被遮蔽的半胱氨酸进行原位标记,然后用荧光成像、定量质谱和连续的双染色标记方法进行分析。
研究人员分别对红细胞和干细胞进行了类似的实验,都取得了成功。在红细胞中,鸟枪式标记方法显示两种细胞骨架蛋白质血影蛋白的两种构型中的被遮蔽半胱氨酸在切应力(shear stress)作用下容易被标记。这一结果突破了长期以来,研究人员打开蛋白折叠需要借助化学反应的一般方法。
由于生物体内的各种生化反应的真正执行者是各种各样的蛋白质,而蛋白质的装配结构和反应特性则是这些过程的基础。研究人员往往将蛋白质的某些特别区域作为新型药物开发的标靶位点。但是,想要找到这些靶标位点就需要首先了解清楚蛋白质的折叠、装配和功能等基础信息。
切应力
物体由于外因(受力、湿度变化等)而变形时,在物体内各部分之间产生相互作用的内力,以抵抗这种外因的作用,并力图使物体从变形后的位置回复到变形前的位置。在所考察的截面某一点单位面积上的内力称为应力。同截面相切的称为剪应力或切应力。
在液体层流中相对移动的各层之间产生的内摩擦力的方向一般是沿液层面的切线,流动时液体的变形是这种力所引起的,因此叫做切变力(又叫剪切力),单位面积上的切变力叫做切应变力,又称切应力。
流体力学中,切应力又叫做粘性力,是流体运动时,由于流体的粘性,一部分流体微团作用于另一部分流体微团切向上的力。
血影蛋白
血影蛋白spectrin 存在于哺乳类动物红细胞膜的内面(细胞质侧)。是类似肌球蛋白的膜的外在性蛋白之一种。是膜里侧结构蛋白质(参见细胞膜里侧结构)之一,除起支持双层脂质外,还有保持红细胞外形的作用,占里侧结构蛋白之60—70%。用低浓度盐溶液抽提可从膜游离出来。在37℃下抽提,则得到化学性、结构性都很相似的分子量24万的α-亚单位〔1带、构成红细胞的蛋白质多以于十二烷基硫酸钠存在下的电泳带的号数来称呼。参见红细胞膜(表)〕以及分子量22万的β-亚单位(2带)所组成的长约100纳米的线状二聚体。而如果在低温下提取,则得到由2分子二聚体相接的四聚体。关于红细胞的里侧结构,由血影蛋白的四聚体与短的肌动蛋白线状体或4.1带蛋白相结合,形成网状结构,另一方面与膜之间通过锚蛋白(ankyr-in,2.1带)与作为膜蛋白的3带蛋白质结合。