骨形成蛋白 如何从细胞内运输到细胞外?
骨形成蛋白(bone morphogenetic protein,BMP)是一类重要的形态发生素,其介导的信号通路不仅广泛参与胚胎发育、器官形成、组织再生等生命过程,还与多种疾病及肿瘤发生密切相关,因此BMP信号通路受到学术界的广泛关注。然而,作为一类经典的胞外信号分子,BMP是如何从细胞内分泌和运输到细胞外?这一问题一直困扰着学术界。
中国科学院水生生物研究所孙永华团队利用斑马鱼模型,发现敲降豆蔻酰化富丙氨酸C激酶底物蛋白(MARCKS)家族成员marcksb导致BMP信号减弱且胚胎严重背部化,细胞移植实验证实marcksb介导BMP活性是细胞自主性的,点突变分析表明Marcksb蛋白磷酸化-去磷酸化所介导的细胞质-细胞膜穿梭对于BMP活性是必需的,进一步的细胞移植和体外实验揭示Marcksb与其互作蛋白Hsp70形成复合体,介导了Bmp2b蛋白从胞内分泌到胞外这一细胞生物学过程。
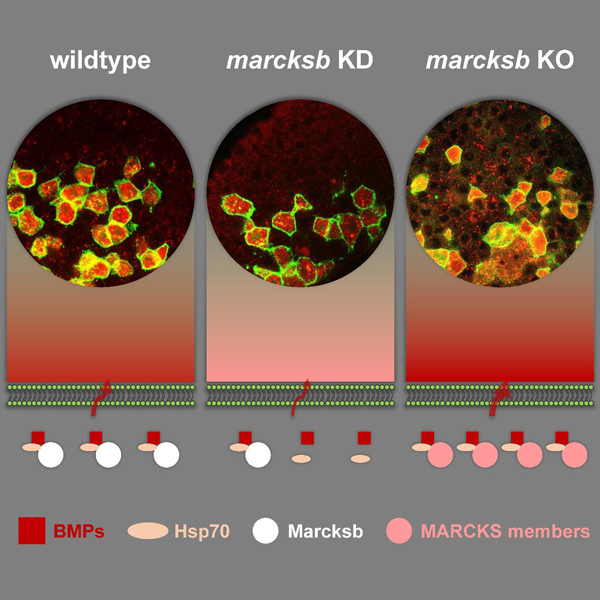
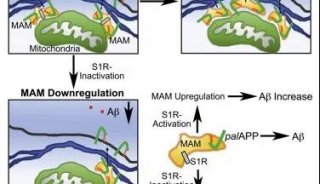
示意Marcksb和Hsp70复合体介导BMP蛋白分泌及marcksb敲除胚胎中的过度遗传补偿机制
同时,该团队利用CRISPR/Cas9技术构建了marcksb的母源合子突变体(MZmarcksb)。有趣的是该突变体Bmp2b分泌不仅没有减弱,反而表现出增强趋势。进一步研究揭示,在突变体中MARCKS家族其他成员在卵子发生过程中表达上调且其合作蛋白Hsp70在合子基因激活时期上调表达,导致胚胎中MARCKS-Hsp70复合体总量上升,从而出现“过度遗传补偿”的效应。
该研究首次揭示了重要形态发生素BMP蛋白分泌途径的介导因子,且为“遗传补偿”效应提供了一个全新的例证。相关研究于9月24日在线发表于国际学术期刊PLOS Genetics,该研究得到国家自然科学基金创新群体项目、优青项目、面上项目、青年项目,中科院青年创新促进会等资助。
-
仪器推荐
 询底价 Tel:400-6699-117 转 7335
询底价 Tel:400-6699-117 转 7335 -
仪器推荐
-
仪器推荐
-
仪器推荐
-
仪器推荐