新CRISPR转基因鼠--体内基因表达和表观遗传修饰精准调控
CRISPR-Cas9系统为基础的基因编辑技术极大的推动了生物医学研究的进步。除直接编辑基因组DNA外,研究者还将失活型Cas9(dCas9)与转录调控元件或染色体修饰元件融合,构建出可实现转录和表观遗传学修饰调控的新工具如CRISPRa(转录激活工具),CRISPRi(转录抑制工具)以及CRISPRoff等(详见BioArt报道:Cell | 新型表观遗传编辑器CRISPRoff,让持久可遗传且可逆的转录调控成为现实)【1-3】。这类工具被广泛用于基因功能研究、高通量筛选和疾病治疗并取得众多成果(详见BioArt报道:Cell丨精确制导,安全提升,基于靶向表观遗传治疗的新一代CRISPR/Cas9技术—附专家点评;Nat Neuro丨清华姚骏组等利用dCas9/CRISPRi在小鼠脑内实现多基因同时抑制—杨辉点评)【4,5】。此外,研究者还构建出相应的转基因小鼠模型,为体内研究提供了重要的平台(详见BioArt报道:杨辉、黄鹏羽合作组利用dCas9转基因小鼠在脑内实现多基因同时激活)【6】,不过现有的转基因小鼠模型依然存在不足,难以实现基因表达和表观遗传修饰的条件性控制和精准调控。
2021年8月2日,来自美国杜克大学生物工程系的Charles A. Gersbach实验室在Nature Methods发表题为Transgenic mice for in vivo epigenome editing with CRISPR-based systems的论文。文章构建出两种新的CRISPR转基因小鼠模型Rosa26-LSL-dCas9-p300core(dCas9p300)和Rosa26-LSL-dCas9-KRAB (dCas9KRAB)。这两种模型中,dCas9p300和dCas9KRAB可通过Cre重组酶诱导表达,最终实现体内基因表达和表观遗传修饰的精准调控。

研究伊始,研究者通过定点插入策略构建出两种转基因小鼠模型LSL-dCas9-p300core (dCas9p300)和Rosa26-LSL-dCas9-KRAB (dCas9KRAB)。其基本原理是在Rosa26位点整合CAG promoter-loxP-stop-loxP(LSL)-Flag--dCas9-p300core (dCas9p300)或CAG promoter -loxP-stop-loxP (LSL)-Flag --dCas9-KRAB (dCas9KRAB)元件(图1)。两种小鼠模型中,因为loxP-stop-loxP (LSL)元件的存在,正常条件下dCas9p300和dCas9KRAB并不表达;只有当Cre重组酶和gRNA表达时,dCas9p300和dCas9KRAB才会被诱导表达并发挥功能,从而实现体内基因表达和表观遗传修饰的精准调控。
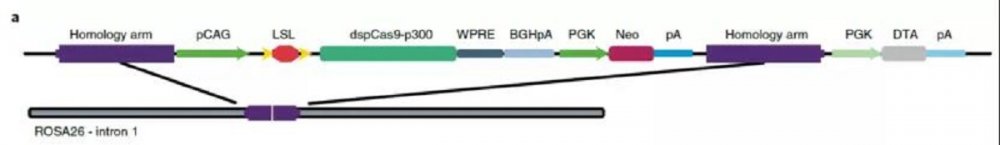
图1 转基因小鼠模型关键元件示意图
研究者首先利用AAV9:CMV.Cre病毒证实两种小鼠模型中的dCas9p300和dCas9KRAB能被诱导表达成功。随后,研究者利用AAV9:Cbh.Cre-Pdx1.gRNA病毒在LSL-dCas9-p300core (dCas9p300)小鼠模型的肝脏中成功激活了Pdx1基因的表达。研究者还通过ChIP-seq和RNA-seq对LSL-dCas9-p300core (dCas9p300)小鼠模型中基因表达和表观遗传修饰调控的特异性进行了分析。结果显示,与对照组小鼠(注射AAV病毒表达Cre和阴性gRNA)相比,AAV9:Cbh.Cre-Pdx1.gRNA病毒仅促进Pdx1.gRNA的靶位点处的dCas9特异性富集和H3K27ac修饰的增加(已知dCas9p300能促进H3K27ac修饰),并特异性促进Pdx1基因表达。不过需要注意的是,与另一种对照小鼠(不注射病毒,仅注射生理盐水)相比,AAV9:Cbh.Cre-Pdx1.gRNA病毒会导致广泛的H3K27ac修饰增加和大量基因表达异常,这很可能是因为dCas9p300过表达所导致的非特异性脱靶效应。
除在肝脏中证实了小鼠模型的有效性外,研究者还指出,LSL-dCas9-p300core (dCas9p300)小鼠模型还可用于神经系统中基因表达的条件性激活:在原代培养的小脑颗粒细胞和小鼠脑中表达Cre重组酶可成功的诱导Grin2c和Fos基因的特异性激活并改变神经元的电生理特性。
之后研究者发现,给Rosa26-LSL-dCas9-KRAB (dCas9KRAB)小鼠模型通过尾静脉注射AAV9病毒表达Cre重组酶和靶向Pcsk9的gRNA,可有效抑制肝脏和血液中PCSK9的表达。研究者也利用ChIP-seq和RNA-seq对Rosa26-LSL-dCas9-KRAB (dCas9KRAB)小鼠模型中基因表达调控和表观遗传修饰调控的特异性进行了分析。结果证实该小鼠模型中,dCas9的富集、H3K9me3修饰增加(已知dCas9KRAB能促进H3K9me3修饰)以及Pcsk9转录本的表达抑制均呈现出高特异性改变。此外,与dCas9p300过表达导致广泛的H3K27ac修饰增加不同,dCas9KRAB过表达本身不会对非目标位点的H3K9me3修饰产生显著影响,这提示dCas9KRAB可能具有更低的脱靶效应和更高的特异性。
最后,研究者还以Foxp3为靶点,在原代免疫细胞中验证了两种转基因小鼠模型中基因表达和表观遗传修饰精准调控的效果。结果证实,利用两种小鼠模型来源的原代免疫细胞可精准调控Foxp3的表达。不过在调控特异性方面,dCas9p300过表达会导致广泛的基因表达异常和H3K27ac修饰异常,而dCas9KRAB并无类似的脱靶效应,表明dCas9KRAB在安全性上更胜一筹。
总体而言,本研究开发的两种转基因小鼠模型LSL-dCas9-p300core (dCas9p300)和Rosa26-LSL-dCas9-KRAB (dCas9KRAB)能实现体内基因表达和表观遗传修饰的精准调控,这为基因功能的体内研究提供了强大的工具。在安全性和特异性方面,dCas9p300过表达会导致广泛的脱靶效应,而dCas9KRAB过表达则并无明显的脱靶风险,这提示我们,在应用相关的工具小鼠特别是dCas9p300小鼠时,需要谨慎对待相关研究结果,这也告诉我们,CRISPR相关的基因表达调控工具依然有改进的空间。
-
焦点事件

-
项目成果
-
科技前沿