中南民族大学PNAS发表神经科学成果
生物通报道:中枢神经系统利用SNAREs和其他突触蛋白介导的Ca2+触发的突触小泡融合,将神经递质释放到突触间隙。Complexin——一个小的胞浆蛋白,对于调节自发性minirelease和激活Ca2+触发的融合,发挥着双重的作用,但是目前其分子机制还不是非常明确。
来自中南民族大学、斯坦福大学和西安交通大学等处的研究人员发现,哺乳动物complexin的C端结构域,可以一种曲率依赖性的方式与膜相互作用,类似于其他曲率传感蛋白,例如α突触核蛋白。连同以前的线虫complexin研究,这些结果表明,C端结构域的曲率传感是进化上保守的。此外,突触小泡到高度弯曲膜的定位,对于调节complexin的同步释放,是非常重要的。相关研究结果发表在最近的《PNAS》杂志。延伸阅读:盘点现代神经科学中的新旧技术(上);盘点现代神经科学中的新旧技术(下)。
中南民族大学生物医学工程学院的阳小飞(Xiaofei Yang)教授、斯坦福大学的刁佳杰(Jiajie Diao)博士和美国科学院院士、斯坦福大学的Axel T. Brunger教授,是本文共同通讯作者。阳小飞教授博士毕业于华中科技大学,曾在美国西南医学中心、斯坦福大学从事博士后研究,长期从事囊泡转运与释放,钙离子调节神经递质释放机制的科学研究工作。在包括Science,Neuron,PNAS,J Neurosci等国际著名期刊在内的各类SCI收录期刊中发表文章10余篇文章,研究成果在国际上有较大影响。
Axel Thomas Brunger教授现任美国科学院院士,美国斯坦福大学分子细胞生理学教授,是结构生物学的权威人士,其研究领域包括神经传递的分子机制、囊泡运输和膜融合的分子机理,X射线晶体学以及核磁共振波谱学方法检测蛋白结构,计算机模拟生物大分子,已在Science、 Nature、Proc Natl Acad Sci、Nature Protocol、J Biol Chem和Sturcture等国际一流学术专业期刊发表多篇论文,并且担任多个国际学术期刊如Proc Natl Acad Sci和Biophysical Journal的编委。
突触小泡的膜融合是神经系统中神经递质释放的一个重要过程。主要融合机器包括SNARE(可溶性NSF附着蛋白受体)融合蛋白synaptobrevin/VAMP2(囊泡相关膜蛋白)、syntaxin-1和SNAP-25及其他突触蛋白,包括突触结合蛋白、complexin、Munc13和Munc18。Complexin是一个小的胞浆蛋白,在哺乳动物、果蝇和线虫中是进化保守的,它与突触结合蛋白合作,调节着突触囊泡的胞吐作用。
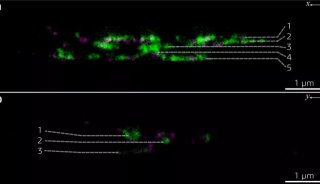
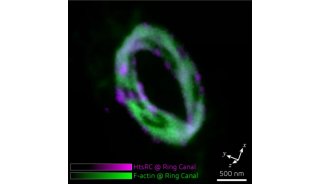
这项研究主要集中在complexin-1亚型(简称Cpx)。Cpx可以分成四个结构域,具有不同的功能:灵活的N端和C端结构域,一个辅助结构域和一个中央α螺旋结构域。Cpx的N端结构域对于小鼠神经元和分离的嗜铬细胞中的快速同步释放,起着一定的作用。C端结构域与磷脂结合,它对于神经元中的突触囊泡启动,非常的重要。没有C端结构域的Cpx不能抑制培养神经元中的自发释放,但是仍能激活培养神经元和重组系统中Ca2+激活的释放。
线虫complexin的C端结构域可通过一个膜结合基序,与弯曲膜相互作用。辅助结构域调节着神经元中的自发融合,并且它抑制重组系统中不依赖于Ca2+的融合。虽然辅助结构域是调节自发释放所必需的,但是,相比较Cpx敲除的修复实验中的野生型神经元,这个结构域的突变,不会对影响Cpx融合的激活,并且在重组系统中它可能被完全去除,同时仍然保持Cpx的激活功能。α螺旋中心结构域可结合SNARE复合体,并且对于目前所有已研究的物种中的Cpx功能,是必不可少的,包括启动、抑制自发融合和激活Ca2+触发的融合。
综合这些数据,该研究小组发现,Cpx是突触囊泡融合的一个重要调节器:它促进Ca2 +触发的突触囊泡融合,连同SNAREs和synaptotagmins,同时抑制或调节某些物种或实验条件下的自发融合。
在这项研究中,研究人员调查了Cpx的C-末端结构域的作用。利用单分子膜结合分析,他们发现,与以往对线虫complexin的研究结果一致,哺乳动物的Cpx优先结合到高度弯曲的膜。对皮质神经元中complexin-1/2双敲除(KD)的修复研究表明,突触囊泡膜定位的行为类似于野生型对照物,而优先的质膜定位可干扰自发释放的抑制。通过这些数据,研究人员发现,C-末端结构域对于Ca2 +触发的释放激活是消耗性的,但适当的膜定位对于自发释放的调节,是非常重要的。
-
科技前沿
-
项目成果