单细胞测序技术(single cell sequencing) 综述(二)
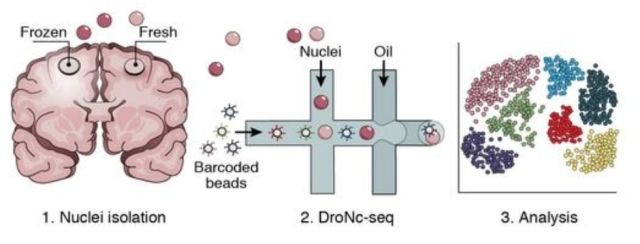
DroNC-seq
10月,Broad研究所张锋教授团队在Nature Methods上发表题为“Massively Parallel Single-Nucleus RNA-Seq with DroNc-Seq (doi: 10.1038/nmeth.4407)” 的文章,提出了一个新的测序技术:DroNc-Seq单细胞表达谱分析技术。该技术融合了sNuc-Seq技术与微流控技术的单细胞核RNA测序方法,可以在结构复杂的组织中更有效地分析大量细胞或细胞核中的RNA,开启单细胞核测序的规模化时代。
在利用单细胞技术来研究大脑等复杂组织的基因表达时,研究人员总会觉得困难重重,因为复杂组织不易分离,难以辨别,分离细胞的过程会经常破坏目的神经元和RNA。sNuc-seq则利用单个提取的细胞核作为起始材料,通过观察细胞核去理解不同的细胞类型和动态过程,如神经的形成。但sNuc-Seq是一种低通量的技术,其应用规模受到了限制。为扩大研究的应用规模,实现一次可研究数千个细胞核的高效测序,研究团队将目光转向了Drop-Seq。它将单细胞与带有DNA条码的微珠一起包裹在微滴中,大大加速表达谱分析实验,同时降低成本。最终,他们开发出了融合两种技术的DroNc-Seq方法。为检验方法的准确性与效率,研究人员利用DroNc-Seq对小鼠细胞系和脑组织进行了分析,并与Drop-Seq、sNuc-Seq以及其他较低通量的单细胞RNA-Seq方法进行比较。结果显示DroNc-Seq表现出了灵敏、高效且无偏向的细胞分类能力。该技术很可能用于人体细胞图谱计划项目。
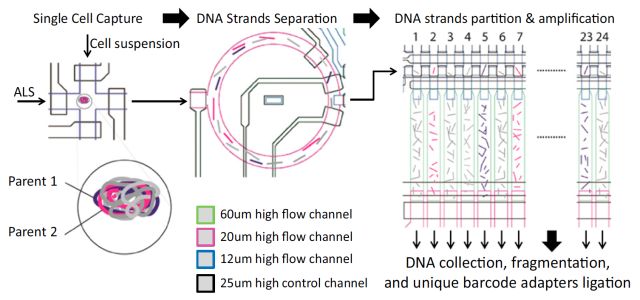
SISSOR
11月加州大学圣地亚哥分校张鹍教授团队在PNAS上发表题为“Ultra-accurate Genome Sequencing and Haplotyping of Single Human Cells (doi: 10.1073/pnas. 1707609114)”的文章。开发了一个名为“SISSOR” (微流体反应器法单链测序)的方法,用来进行准确的单细胞基因组测序和单倍体分型。
正常人类单个细胞DNA含量为6.6pg,相对于测序所需的ug级相当微量,并且有些DNA是独一无二的,因此单细胞测序的关键一环是全基因组扩增(WGA),常见的方法如,MDA、MALBAC等需要用DNA聚合酶对细胞基因组做大量的体外扩增,然后构建文库进行相对读长较短的高通量测序。这些方法有两个明显的缺点:1,聚合酶的错误扩增可以在基因组上产生成千上万的假阳性。2,短的序列读长几乎不包含任何单倍体类型信息。
SISSOR方法是利用微流体处理器将单个细胞染色体DNA的正负双链进行分离,并将百万碱基大小的DNA片段随机分割成大量的纳升级的组分,用于扩增和构建测序文库,从而实现对同源染色体的互补双链分别进行独立的测序。这样就能够进行Long-range单倍体的组装,并且还能利用冗余和单倍体型信息纠正测序错误。结果显示,该方法的纠错能力可以将单细胞测序错误率降低至10-8,并且单倍体片段平均可组装长度为500 kb,contig达到N50大于7 Mb。该方法能够获得精准的单细胞基因组序列以及单倍体信息以满足临床对基因组测序的不同需求。SISSOR是对单细胞测序技术的一次突破,将测序准确性提高了两个数量级。这项技术潜在的应用包括对患者血液中循环肿瘤细胞进行准确的检测,以及对体外受精的健康胚胎进行筛选和检测经过基因编辑的人体细胞。
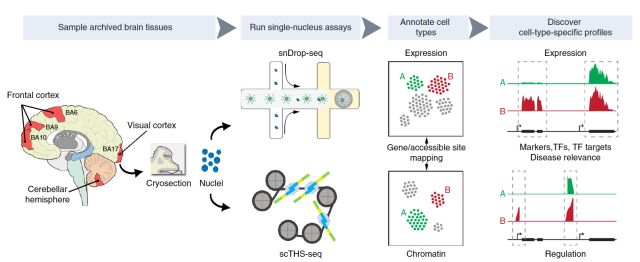
snDrop-seq+scTHS-seq
张鹍教授团队本月又在Nature Biotechnology杂志上发表了“Integrative single-cell analysis of transcriptional and epigenetic states in the human adult brain (doi: 10.1038/nbt.4038)”的文章。开发了基于冰冻组织高通量单细胞核测序方法来绘制成年人脑第二代单细胞图谱,再次引爆了单细胞研究的热点。
研究人员将视线聚焦于脑组织提取的神经元和胶质细胞单细胞核,克服了样本的限制,使该方法可以应用于新鲜或冻存的脑组织,实现了冻存组织的大规模单细胞检测。另外,这项研究的一个创新之处在于结合了两种高通量单细胞技术:基于微流体的单核测序 (snDrop-seq) 和单细胞转座子超敏感位点测序 (scTHS-seq)的方法。snDrop-seq,不仅可以对成千上万个单细胞同时进行转录组分析,从多方面对细胞类型和细胞状态进行分类,还可用于评估新鲜和冻存人体组织中的特异性表达谱,有助于研究组织的功能异质性。该技术还攻克了在微滴中有效裂解核膜而不引起RNA过度降解的难题。为同时研究表观遗传特征,该团队还开发了scTHS-seq技术。scTHS-seq拥有具有体外转录扩增的线性优势和改造后的超级突变Tn5转座酶,比ATAC-seq灵敏度更高,还提高了高度细胞特异性的远端增强子(distal enhancers)的覆盖度。
研究团队联合应用以上两种方法最终建立了这种可并行检测细胞核转录本和表观遗传特征的高通量测序平台,为综合分析冻存人体组织样本中基因表达和调节提供了途径。研究人员用此方法检测了超过60,000个来自成人大脑皮层和小脑的单细胞,发现了35种不同的神经元和神经胶质细胞亚型。此外他们还将常见的人脑遗传疾病相关的遗传位点定位到特定的细胞类型,揭示了大脑中哪些细胞类型更易受脑部疾病遗传因子的影响。这些发现有助于确定大脑中哪种类型的细胞最容易受到遗传风险因子的攻击,最终绘制一个完整的人脑细胞图谱。
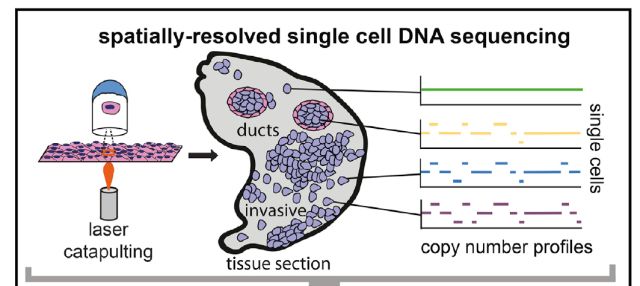
TSCS
本月,美国安德森癌症中心的研究人员在Cell上发表”Multiclonal Invasion in Breast Tumors Identified by Topographic Single Cell Sequencing (doi:10.1016/
j.cell.2017.12.007)” 的研究性文章,发明了一种新的“地形”单细胞测序技术 (Topographic Single Cell Sequencing, TSCS)来研究细胞位置的空间信息,用于研究早期乳腺导管内原位癌 (DCIS)是如何发展为更具有侵袭性的导管癌症 (IDC)。
肿瘤细胞往往存在着各不相同的遗传特征,这被称为肿瘤内异质性。它们独特的细胞构成使得治疗变得更加困难。此前的单细胞DNA测序方法已经打开了探索肿瘤细胞的大门,成为了理解肿瘤内异质性的有力工具,但是这种方法能够去除关于个体肿瘤细胞在组织内精确空间定位的信息。而细胞空间数据对于了解肿瘤细胞的迁移至关重要。研究人员开发的新工具:“地形”单细胞测序 (TSCS) ,该方法提供了有关细胞位置的空间信息,能更准确地从空间上测量和描述单个肿瘤细胞的具体特征。这代表了一个技术上的里程碑,此前的技术只能采用失去了空间信息的悬浮细胞。
研究人员利用TSCS对来自10位具有DCIS和IDC的患者的1293个单细胞进行了分析。研究数据揭示了DCIS和IDC之间的直接基因组谱系,并进一步指出了入侵之前,在导管内发生的大多数突变和DNA拷贝数畸变。表明多个癌细胞克隆可以从导管共同迁移到相邻区域,形成侵入性肿瘤。
TSCS和其他类似的单细胞测序方法在开发早期癌症研究新途径方面具有巨大的潜力。希望这些研究未来能揭示为何一些恶性肿瘤前癌没有发展成恶性肿瘤,而另外一些则形成了侵入形式。